Полиоксидоний: новые аспекты применения
Статьи
Опубликовано в журнале:
«НОВЫЕ ЛЕКАРСТВА» »» № 3/2003 Р. М. Хаитов, профессор, академик РАМН, директор ГНЦ, Институт иммунологии МЗ РФ
Б. В. Пинегин, профессор, зав. отделом иммунодиагностики и иммунокорекции ГНЦ, Институт иммунологии МЗ РФ
В настоящее время продолжается интенсивное изучение механизма действия и медицинского применения отечественного иммуномодулятора Полиоксидония, являющегося физиологически активным соединением с молекулярной массой 100 kD и обладающего выраженной иммуномодулирующей активностью. По своей химической структуре он являетя сополимером N-окиси 1,4-этиленпиперазина и (N-карбоксиэтил-) 1,4-этиленпиперазиния бромида с молекулярной массой 80 kD.
Полиоксидоний разрешен к медицинскому применению у детей и взрослых в двух лекарственных формах: в виде инъекций и в виде суппозиториев.
Инъекционная форма Полиоксидония нашла широкое применение в комплексном лечении при ряде хронических инфекционно-воспалительных процессов любой локализации и этиологии. Показана высокая клиническая и иммунологическая эффективность этого иммуномодулятора в лечении хирургических инфекций, инфекций урогенитального, желудочно-кишечного и бронхолегочного трактов.
Так, в частности, в нашем институте Т. В. Латышевой с соавторами (2001, 2002 гг.) показана эффективность Полиоксидония в лечении хронического рецидивирующего фурункулеза, проявляющаяся в существенном удлинении продолжительности ремиссии. А. Е. Шульженко с соавторами (2001, 2002 гг.) показана эффективность Полиоксидония в лечении хронического генитального герпеса, которая также проявлялась в существенном удлинении срока ремиссии этого (основного клинического показателя эффективности лечения любой хронической рецидивирующей инфекции). С. С. Аршиновой с соавторами. (1999, 2000, 2002 гг.) показана эффективность Полиоксидония в лечении туберкулеза легких. Это проявлялось в более быстром закрытии полостей распада, элиминации возбудителя, рассасывании инфильтратов и исчезновении интоксикации по сравнению с больными, получавшими традиционное антимикобактериальное лечение.
В подавляющем большинстве случаев целесообразно применение иммуномодуляторов в комплексном лечении при хронических инфекционно-воспалительных процессах, и мы считаем, что препаратом первого выбора в этих случаях является Полиоксидоний. Это утверждение основано на ряде положений.
Полиоксидоний хорошо взаимодействует с антибактериальными, противогрибковыми и противовирусными препаратами, а также с интерферонами и индукторами интерферонов. При совместном применении антибиотика и иммуномодулятора мы говорим о “двойном” ударе по причине заболевания. Полиоксидоний стимулирует функциональную активность клеток иммунной системы: непосредственно – нейтрофилы, моноциты/макрофаги и естественные киллеры, опосредованно – клеточный и гуморальный иммунитет, от которых в конечном итоге зависит элиминация возбудителя из организма, а антимикробный препарат убивает или понижает функциональную активность возбудителя. Но главным преимуществом Полиоксидония по сравнению с другими иммуномодуляторами является многогранность его положительного воздействия на организм человека.
Помимо иммуномодулирующего эффекта Полиоксидоний обладает детоксицирующими, антиоксидантными и мембранопротекторными свойствами, обусловленными особенностями его химической структуры. Именно наличие комплекса этих свойств обуславливает высокий клинический эффект Полиоксидония, его преимущества перед другими иммуномодуляторами и делает его препаратом первого выбора при лечении заболеваний, связанных с нарушениями иммунной системы.
Рассмотрим более подробно детоксикационные свойства инъекционной формы Полиоксидония. Эти свойства препарата хорошо демонстрируются на модели ожоговой болезни и панкреонекроза. Н. А. Гординская с соавторами (2002 г.) применяли Полиоксидоний в комплексном лечении 24 пациентов с термическими ожогами на площади от 30% до 50% поверхности тела. После курса Полиоксидония у пациентов существенно снижался уровень печеночных аминотрансфераз и среднемолекулярных пептидов. Снижалось также количество циркулирующих иммунных комплексов. Анализируя динамику концентрации токсических веществ в плазме ожоговых больных, авторы обнаружили резко повышенное содержание бактериальных липополисахаридов в период токсемии. На фоне традиционной терапии практически не регистрировалось снижение концентрации ЛПС. На фоне иммунотерапии Полиоксидонием уровень бактериальной эндотоксемии достоверно снижался.
В. Л. Аверкиев с соавторами (2002 г.) оценивали у 76 больных острым деструктивным панкреатитом в послеоперационном периоде помимо иммунного статуса состояние перекисного окисления липидов и интоксикационный синдром. У 23 больных в комплексном лечении этого заболевания был применен Полиоксидоний. В послеоперационном периоде в 1-е сутки по сравнению с дооперационным уровнем отмечается прогрессирование липопероксидации, что связано, вероятно, с наркозом, операционной травмой и с реперфузией ткани поджелудочковой железы после рассечения ее капсулы и абдоминизации. При применении Полиоксидония происходит снижение уровня малонового диальдегида и диеновых кислот. В послеоперационный период у больных происходит существенное повышение молекул средней массы (МСМ), свидетельствующее о тяжелом синдроме эндогенной интоксикации вследствие воспалительного процесса и операционной травмы. При применении Полиоксидония отмечается планомерное понижение этого показателя и к 14-м суткам уровень МСМ достигает нормы.
При анализе биохимических показателей выявлено достоверное снижение уровней билирубина, креатинина и мочевины сыворотки крови, уменьшение активности аминотрансфераз у всех больных, особенно выраженное в группе больных, получаших Полиоксидоний. Авторы полагают, что с выраженными детоксикационными свойствами Полиоксидония связано и снижение летальности (52% в контрольной и 23,1% в опытной группе) и частоты гнойно-септических осложнений (92% в контрольной и 43,9% в опытной группах). Высокая клиническая эффективность лечения Полиоксидонием четко связана и с улучшением параметров иммунного статуса.
Наряду с инъекционной формой в клиническую практику широко внедряется Полиоксидоний в виде суппозиториев. Эта форма препарата показана к применению практически при всех тех же нозологиях, что и инъекционная. На наш взгляд, особый интерес представляет применение суппозиториев для лечения хронических заболеваний урогенитального тракта.
М. Н. Шатохин с соавторами (2002 г.) показали эффективность при использовании Полиоксидония в виде суппозиториев в комплексном лечении хронического простатита. После традиционной терапии болевой синдром сохранился у 75% пациентов, дизурические расстройства наблюдались у 70% больных, простаторея и боль или дискомфорт при эякуляции остались в 40% случаев. Качество жизни практически не улучшилось.
После лечения с включением суппозиториев Полиоксидония болевой синдром купировался у всех пациентов, дизурические явления, простатоторея и дискомфорт при эякуляции сохранились лишь у 1 пациента. Качество жизни заметно улучшилось (3 балла по сравнению с 8,8 балла до лечения). При ректальном пальцевом исследовании характеристики предстательной железы улучшились: исчезла болезненность, повысился тонус. В секрете предстательной железы понизились концентрации провоспалительных цитокинов. Особенно интересными, на наш взгляд, являются данные авторов об изменениях местного иммунитета. Оказалось, что при применении суппозиториев Полиоксидония происходило снижение провоспалительных цитокинов (ФНОa, ИЛ-1b, ИЛ-6) при повышении содержания ИЛ-4 и sIgA в секрете предстательной железы.
М. Х. Коджаева с соавторами (2002 г.) применяли Полиокидоний в виде суппозиториев в комплексной терапии у 34 женщин в возрасте от 16 до 39 лет с диагнозом «хронические рецидивирующие урогенитальные инфекции». У этих женщин наблюдалось значительное улучшение клинических и лабораторных показателей. Это выражалось в увеличении количества лактобактерий, увеличении в вагинальном секрете IgA и sIgA, улучшении кольпоскопической картины, уменьшении выделений и т. д.
Л. Е. Смирновой с соавторами (2002 г.) проведена комплексная терапия 58 больных с обострением хронических воспалительных заболеваний внутренних половых органов (ХВЗВПО). Основную группу составили 36 пациенток, получавшие Полиоксидоний в виде суппозиториев на фоне базисной антибактериальной терапии. В контрольную группу вошли 22 больные, которым проводилась только базисная терапия. У больных основной группы отмечена более выраженная динамика исчезновения основных клинических симптомов, более ранняя нормализация УЗ-картины, элиминация возбудителей из слизи цервикального канала в 92% случаев по сравнению с 32% у больных контрольной группы. Также после проведенной терапии у больных основной группы, в отличие от пациенток контрольной группы, нормализовался уровень концентрации иммуноглобулинов в содержимом влагалища. Полученные данные свидетельствуют о высокой эффективности комплексной терапии ХВЗВПО в стадии обострения с применением Полиоксидония.
Полученные данные говорят о целесообразности применения Полиоксидония в гинекологической практике у женщин с длительной хронической бактериальной инфекцией.
Т. Н. Кузина и соавторы, изучали некоторые параметры местного иммунитета слизистой влагалища у 39 женщин в возрасте 19–35 лет, получавшие полиоксидоний ежедневно интравагинально, №10. Больные были разделены на две группы. Первая группа состояла из ВИЧ-серонегативных женщин (14), которые имели в качестве постоянных половых партнеров ВИЧ-инфицированных мужчин. Вторая группа – 25 ВИЧ-инфицированных женщин (стадия В по CDC). В первой группе пациенток, которые были подвергнуты катамнестическому наблюдению в течение года, ВИЧ-инфицирования женщин не регистрировалось несмотря на то, что они имели постоянные половые контакты с ВИЧ-инфицированными мужчинами, которые не пользовались презервативами.
Во второй группе пациенток выявлено, что у ВИЧ-инфицированных женщин возросло число резидентных макрофагов слизистой оболочки влагалища, экспрессирующих FcR и C3bR, увеличилась их фагоцитарная активность, что сопровождалось усилением кислородзависимого метаболизма, а также возрастанием адаптивных возможностей. У них было зарегистрировано уменьшение провирусной нагрузки резидентных мононуклеаров слизистой оболочки влагалища и цервикального канала (от 645±132,5 genc/107cell до 160±13,5genc/107 cell) и мононуклеаров периферической крови; вирусная нагрузка плазмы также уменьшилась (от 684±234,4 genc/ml до 216±74,4 genc/ml). Эти данные позволили авторам сделать вывод, что Полиоксидоний обладает выраженной иммунотропной активностью при местном применении.
Помимо инъекционной формы и суппозиториев разрабатываются новые перспективные способы применения Полиоксидония. В. П. Вавилова с соавторами (2002 г.) предложили интраназальную терапию Полиоксидонием детей, часто болеющих ОРВИ на фоне хронического аденоидита (40 детей в возрасте 3–6 лет) с учетом характера поражения лимфоглоточного кольца (нейтрофильно-макрофагальный вариант). У детей, страдающих хроническим аденоидитом с гнойным экссудатом, Полиоксидоний применялся местно эндоназально в течение 10 дней. Проспективное наблюдение в течение 3,5 месяцев подтвердило эффективность иммуномодулятора в плане становления местного иммунитета респираторного тракта, нормализации микробного пейзажа носоглотки и улучшения клинической картины с уменьшением размеров гипертрофированной глоточной миндалины. Представленные данные показывают перспективность создания новой лекарственной формы полиоксидония для лечения заболеваний ЛОР-органов и стимуляции местного иммунитета верхних дыхательных путей.
В целом Полиоксидоний является уникальным иммуномодулирующим препаратом, сочетающим в себе множество положительных качеств. Это, без сомнения, выдающееся достижение российских ученых. Полиоксидоний занял достойное место в арсенале отечественных лекарственных средств и среди иммуномодуляторов бесспорно является препаратом первого выбора. Без сомнения, по мере широкого медицинского применения этого препарата клинические показания для его использования будут расширяться, будут уточняться схемы и дозы его назначения, но уже сегодня можно с уверенностью сказать, что применение Полиоксидония позволило существенно повысить эффективность лечения и профилактики ряда заболеваний, связанных с нарушениями иммунной системы.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Аллергический ринитАллергияПиелонефритПри простудеПростатитСредства от простудыТаблеткиУколы от аллергииЦистит
Содержание статьи
- Полиоксидоний: для чего
- Полиоксидоний: аналоги
- Что лучше: Галавит или Полиоксидоний
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Как бы мы тоже хотели, чтобы появилось такое средство, которое защитит нас от вирусов и бактерий навсегда или излечит от простуды за один день. Иммунитет человека работает без перерыва. Но бывают такие состояния, что иммунитет ослаблен из-за хронического заболевания или после перенесенной инфекции, или после оперативного вмешательства. В такой ситуации выручают иммуностимуляторы.
Одним из таких препаратов является Полиоксидоний. И хотя его эффективность не доказана, его часто назначают врачи и применяют пациенты. Провизор Анна Суменкова рассказала, для чего его применяют, о его формах выпуска и способах применения. Привела примеры других иммуностимуляторов, и сравнила Полиоксидоний и Галавит.
Полиоксидоний: для чего
В составе Полиоксидония содержится действующее вещество азоксимера бромид. Он обладает иммуномодулирующим действием: препарат стимулирует выработку интерферона, чем и повышает иммунитет.
Он обладает еще несколькими эффектами:
- детоксицирующим (выводит токсины)
- антиоксидантным (нейтрализуют окислительное действие)
- противовоспалительное
Полиоксидоний выпускается в форме таблеток, суппозиториев (свечей) и раствора для инъекций и местного применения. Его применяют у детей с 3-х лет и взрослых.
Показаниями к применению Полиоксидония являются:
- профилактика и комплексное лечение заболеваний ЛОР-органов
- комплексное лечение аллергических заболеваний (поллиноз, бронхиальная астма и др.)
- профилактика герпетической инфекции
- профилактика снижения иммунитета на фоне старения или других факторов.
Полиоксидоний свечи: инструкция по применению
Свечи предназначаются как для ректального, так и для вагинального применения. Действующее вещество — то же самое. Вспомогательные компоненты — другие, за счет особенностей формы выпуска.
Показания к применению отличаются от показаний таблеток. Свечи дополнительно используют при следующих состояниях:
- пиелонефрит
- уретрит
- цистит
- простатит
- кольпит
- цервицит
- бактериальный вагиноз
- различные формы туберкулеза
Вам может быть интересно: Симптомы и лечение цистита у женщин
Свечи выпускаются в дозировке 6 мг и 12 мг. Их применяют вагинально или ректально 1 раз в день. Свечи с дозировкой 12 мг предназначены только для взрослых. При ректальном введении кишечник предварительно освобождают. Для лечения гинекологических болезней свечи вводят перед сном во влагалище. Свечи с дозировкой 6 мг применяют у детей с 6 лет.
Полиоксидоний: уколы
Раствор для инъекций Полиоксидоний выпускают в ампулах. Раствор также пьют и капают в нос. Чаще такие способы применяются для лечения детей. Показания к применению не отличаются от показаний таблеток. Дозировка действующего вещества тоже составляет 3 мг и 6 мг.
Полиоксидоний: аналоги
Полиоксидоний — иммуномодулирующее средство, поэтому аналоги мы подобрали из этой же группы. Назовем 6 известных препаратов:
- Эргоферон
- Бронхо-мунал
- Трекрезан
- Арпефлю
- ИРС-19
- Галавит
Что лучше: Галавит или Полиоксидоний
Разберемся, какой препарат лучше: Галавит или Полиоксидоний. Галавит — иммуностимулирующее и противовоспалительное средство. Действующее вещество у него другое — аминодигидрофталазиндион натрия. В отличие от Полиоксидония, у Галавита список показаний к применению значительно шире. В него входят:
- гнойно-воспалительные заболевания: малого таза, ожоговые воспаления, фурункулез и др.)
- заболевания, вызванные вирусом герпеса
- заболевания, вызванные вирусом папилломы человека
- послеоперационные состояния у женщин в области гинекологии
- гнойно-септические осложнения онкобольных
- пародонтит и другие заболевания слизистой рта и глотки
- язвенная болезнь желудка и двенадцатиперстной кишки
- вирусные гепатиты
- психические расстройства на фоне отмены алкоголя, наркотиков или сильной физической нагрузки
Есть еще несколько отличий. Галавит назначают с 6 лет, а не с 3-х, как Полиоксидоний. Галавит для инъекций выпускается в виде порошка, из которого готовят раствор. Ни тот, ни другой препарат не обладает доказанной эффективностью.
Итак, при выборе препарата важно понимать показания и противопоказания. Отсюда и будет ответ на вопрос, что лучше для каждого пациента.
Краткое содержание
- Полиоксидоний — иммуностимулирующий и противовоспалительный препарат.
- Его применяют в основном для профилактики заболеваний гриппа и ОРВИ, и их лечения.
- Полиоксидоний выпускается в форме таблеток, свечей и раствора для инъекций.
- Аналогов у Полиоксидония достаточно много, более 20 средств. Их показания к применению могут отличаться.
- Галавит отличается от Полиоксидония действующим веществом, показаниями и противопоказаниями.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
- Введение
Современная патология характеризуется ростом заболеваний, связанных с вторичной иммунологической недостаточностью. Она проявляется в частых, вялотекущих, рецидивирующих инфекционно-воспалительных заболеваниях дыхательного, желудочно-кишечного и урогенитального трактов, кожи и мягких тканей. Применение антибактериальных лекарственных средств нередко бывает малоэффективным или вообще неэффективным. Становится очевидным, что без повышения иммунологической реактивности трудно (или невозможно) добиться хорошего клинического эффекта при различных хронических инфекционно-воспалительных процессах. Одним из главных методов коррекции иммунитета является применение иммунотропных лекарственных средств (ИТЛС). В настоящее время врач-иммунолог располагает достаточно большим набором таких препаратов. По происхождению их можно разделить на три группы: полимерные, экзогенные и эндогенные [20]. В данном обзоре представлены только те ИТЛС, которые разработаны и внедрены в клиническую практику за последнее десятилетие и являются новейшими достижениями отечественной науки.
- Полимерные ИТЛС
К полимерным ИТЛС, полученным с помощью направленного химического синтеза, относится препарат полиоксидоний (выпускается в виде ампул по 3 мг). Он представляет собой N-оксидированное производное полиэтиленпиперозина с высоким молекулярным весом [13,15]. Препарат обладает широким спектром иммунофармакологического воздействия. Он стимулирует функциональную активность трех важнейших субпопуляций фагоцитов: подвижных макрофагов тканей, циркулирующих фагоцитов крови и оседлых фагоцитов ретикуло-эндотелиальной ткани. Это проявляется в повышенной способности фагоцитов поглощать и переваривать микробы, в образовании активных форм кислорода, повышении миграционной активности нейтрофилов. Результатом активации оседлых макрофагов ретикуло-эндотелиальной системы под влиянием полиоксидония является более эффективная элиминация из организма чужеродных частиц. Суммарным следствием активации факторов естественного иммунитета является повышение устойчивости животных к экспериментальным бактериальным и вирусным инфекциям. Полиоксидоний повышает также функциональную активность Т- и В-лимфоцитов, усиливая кооперативное взаимодействие между этими двумя важнейшими клеточными популяциями. При введении экспериментальным животным полиоксидония совместно с каким-либо антигеном наблюдается более чем десятикратное усиление антителообразования к этому антигену. Этот эффект отмечается к Т-зависимым и Т-независимым антигенам как животного, так и микробного происхождения. Полиоксидоний способен активировать иммунные реакции у животных с тяжелыми формами иммунодефицитов, в частности усиливать антителообразование у:
- мышей с врожденной аплазией тимуса (мыши nude);
- мышей с искусственно созданным дефицитом Т-системы иммунитета (В-мыши);
- мышей с искусственно индуцированной вследствие введения циклофосфамида деструкцией В-системы иммунитета;
- старых мышей с возрастным иммунодефицитом.
Кроме того, для полиоксидония характерно еще одно важное качество, не связанное с активацией иммунной системы: он обладает детоксицирующими свойствами. В силу своего молекулярного веса и наличия на поверхности молекулы большого количества различных активных групп он активно адсорбирует как растворимые токсические субстанции, так и микрочастицы, циркулирующие в крови. Полиоксидоний также обладает способностью снижать токсичность ряда лекарственных средств.
Препарат рекомендуется в качестве иммуномодулятора в комплексной терапии заболеваний или состояний, сопровождающихся угнетением иммунитета, так как при этих патологических процессах показал высокую клиническую эффективность. Он назначается внутримышечно, 5-7 инъекций на курс. ХНЗЛ были использованы две схемы лечения с разовыми дозами 6 мг (1-я) и 12 мг (2-я). При лечении полиоксидонием больных хроническим бронхитом в фазе ремиссии было отмечено удлинение сроков ремиссии и исчезновение астенического синдрома. Хороший эффект (быстрое купирование симптомов заболевания, сокращение сроков нетрудоспособности, достижение стойкой ремиссии, нормализация лабораторных показателей и др.) дали 1-я и 2-я схемы лечения в 63,6 и 77,8% случаев соответственно. Назначение в качестве препарата сравнения иммуномодулятора нуклеината натрия дает положительные результаты у 51,4% больных. Лечение полиоксидонием больных хроническим бронхитом в период обострения в комплексе с антибиотиками способствовало значительному улучшению их общего состояния, при этом уменьшались слабость, потливость, кашель и количество выделяемой мокроты, нормализовалась температура, исчезали хрипы в легких. Применение 1-й и 2-й схем лечения привело к хорошему эффекту у 66,6 и 87,5% больных соответственно. При лечении нуклеинатом натрия хороший эффект был только у 54,5%. При применении плацебо как в стадии ремиссии, так и в период обострения наблюдался только удовлетворительный эффект: купирование симптомов заболевания и положительная динамика в лабораторно-инструментальных данных.
У больных под воздействием полиоксидония происходила нормализация иммунонологических показателей: увеличение CD3 T-лимфоцитов, увеличение NK-активности, нормализация функциональной активности фагоцитарных клеток.
У пациентов с хроническим рецидивирующим фурункулезом в стадии ремиссии наблюдалось значительное удлинение ремиссии и снижение симптомов интоксикации. Хорошие результаты получены при применении 1-й и 2-й схем лечения у 60 и 81,8% больных соответственно. У больных, получавших нуклеинат натрия, наблюдался только удовлетворительный эффект (33,3%). У больных, получавших плацебо, положительной динамики клинической картины не выявлено. При применении полиоксидония в комплексе с антибиотиками у больных фурункулезом в стадии обострения происходила быстрая регрессия фурункулов, уменьшение их количества, уменьшение симптомов интоксикации. Хороший эффект при применении 1-й и 2-й схем лечения был у 80 и 90,9% больных соответственно. Положительная клиническая картина сопровождалась нормализацией иммунологических показателей.
Ярким примером клинической эффективности препарата являются результаты, полученные при лечении хирургических инфекций: сепсиса, перитонита, абсцессов и инфильтратов брюшной полости, гнойно-воспалительных процессов в малом тазу [11,18]. В группе, получавшей полиоксидоний, хорошие и отличные показатели наблюдались у 75 и 80% больных соответственно. В контрольной группе хороший и отличный результат был получен у 42% больных.
Хороший клинический эффект полиоксидония при хирургических инфекциях в значительной степени связан с его способностью усиливать процессы регенерации. Это проявлялось в быстром очищении раны от гнойно-некротических масс, ее эпителизации и сокращении сроков заживления (на 21%). Включение полиоксидония в комплексное лечение гнойно-раневых инфекций способствовало быстрому очищению раны от микроорганизмов.
У всех больных, имеющих в послеоперационный период гнойно-септические осложнения, наблюдались нарушения иммунного статуса, степень выраженности которых зависела от тяжести этого осложнения: снижалась функциональная активность фагоцитарных клеток, уменьшался уровень CD3 и CD4 T-лимфоцитов и IgG. Применение поолиоксидония существенно улучшало ряд биохимических и иммунологических параметров у хирургических больных. Во всех группах, получавших этот препарат, в отличие от контрольной группы снижалась активность печеночных ферментов (АСТ и АЛТ), уровень билирубина, креатинина и мочевины сыворотки крови, что, вероятно, связано с антиоксидантными и детоксицирующими свойствами полиоксидония.
- ИТЛС экзогенного происхождения
К ИТЛС экзогенного происхождения относятся препараты бактериального и грибкового происхождения. К медицинскому применению разрешены такие средства микробного происхождения, как БЦЖ, пирогенал, продигиозан, нуклеинат натрия, рибомунил, бронхомунал и др. Все они обладают способностью усиливать функциональную активность нейтрофилов и макрофагов [7]. Как известно, микобактерии туберкулеза, входящие в состав полного адьюванта Фрейнда, обладают выраженной способностью стимулировать неспецифическую резистентность, клеточный и гуморальный иммунитет. Анализ компонентов микобактерий, ответственных за этот стимулирующий эффект, привел к открытию в составе пептидогликана клеточной стенки этих и практически всех других бактерий нового мощного иммуностимулятора — мурамилдипептида [22, 23]. Российские специалисты почти одновременно с французскими исследователями выделили из противоопухолевого препарата бластолизина — гидролизата клеточной стенки L.bulgaricus вещество, сходное по химической структуре, которое в дальнейшем было получено синтетическим путем [1]. Оно успешно прошло клинические испытания и получило фармакопейное название ликопид. Он выпускается в таблетированной форме по 10 мг и 1 мг. Препарат показал полную безвредность и высокую эффективность при ряде вторичных иммунодефицитных состояний [6]. Главной мишенью ликопида в организме являются клетки моноцитарно- макрофагального ряда. Он усиливает практически все функции клеток этой системы, в частности обеспечивает следующие процессы:
- поглощение и киллинг микроорганизмов, вероятно за счет активации лизосомальных ферментов и образования активных форм кислорода;
- киллинг чужеродных клеток (опухолевых и вирусинфицированных);
- экспрессию HLA-DR антигенов;
- синтез цитокинов (ИЛ-1,ТНФ, колониестимулирующий фактор, g-интерферон и др.). Благодаря вышеперечисленным свойствам ликопид обладает следующими клиническими эффектами:
- антиинфекционным;
- противовоспалительным;
- репарационным;
- лейкопоэтическим;
- противоопухолевым (в эксперименте);
- детоксицирующим и гепатопротекторным.
В ряде случаев ликопид эффективен и в виде монотерапии. Так, его своевременное применение по 1 мг. 3 раза в день в течение 10 дней в профилактических целях позволило существенно снизить (в 2,5 раза) сезонные острые респираторные заболевания. В самом начале развития патологического процесса ликопид оказывается эффективным (по 10 мг 1 раз в сутки в течение 10 дней) при папилломатозе шейки матки.
Применение его по той же схеме после хирургического лечения позволило свести практически к нулю рецидив папилломатоза. При использовании в качестве препарата сравнения нуклеината натрия эффективность лечения составила около 60%. Ликопид оказался также высокоэффективным при комплексной терапии острых и хронических герпетических инфекций всех локализаций. Схема лечения зависит от тяжести патологического процесса При легких и средней тяжести формах заболевания ликопид целесообразно принимать по 2 мг 3 раза в день, при тяжелых — по 10 мг 2-3 раза в день в течение 10 дней. Его комбинация с противовирусными средствами позволяет быстро купировать патологический процесс и вызвать стойкую ремиссию в течение года и более. Препарат хорошо взаимодействует не только с противовирусными средствами, но и с препаратами интерферона и их индукторами.
Высока клиническая эффективность ликопида и в комплексном лечении такого тяжелого заболевания, как туберкулез легких. Его назначение тремя курсами по 6-7 дней с интервалами в две недели с разовой дозой 10 мг ведет к более быстрому закрытию каверн и прекращению бациллоносительства.
Применение ликопида с целью профилактики хирургических инфекций позволило в несколько раз сократить частоту их развития. При наличии развившегося осложнения ликопид препятствует прогрессированию патологического процесса, возникновению новых осложнений, развитию пневмоний. Кроме того, он показал высокую клиническую эффективность практически при всех видах долго не заживающих ран, а также при трофических язвах.
Клинический эффект, как правило, сопровождается и выраженным улучшением иммунологических показателей. Наиболее четко это показано на примере хирургических инфекций [5,19,21]. Как при профилактике, так и при лечении этих инфекций ликопид оказывал положительное воздействие на гематологические, биохимические и иммунологические параметры. У больных, принимавших по 3 мг ликопида в течение 10 дней, по сравнению с больными, получавшими плацебо, были отмечены следующие статистически значимые положительные изменения:
- повышение количества лейкоцитов, в основном за счет нейтрофилов;
- повышение уровня гемоглобина, общего белка и альбумина;
- понижение уровня билирубина, мочевины и креатинина;
- повышение функциональной активности фагоцитов, определяемой по способности образовывать активные формы кислорода;
- повышение количества Т-лимфоцитов, Т-хелперов и NK-клеток.
- ИТЛС эндогенного происхождения
В настоящее время в качестве ИТЛС эндогенного происхождения для профилактики и лечения вторичных иммунодефицитов применяются иммунорегуляторные пептиды, полученные из центральных органов иммунитета: тимуса и костного мозга и цитокины.
Из ИТЛС, полученных из костного мозга, достаточно широко распространен миелопид (выпускается в ампулах по 3 мг, разработка которого началась в начале 70-х годов, после того как было обнаружено, что костный мозг продуцирует группу биорегуляторных пептидных медиаторов, названных миелопептидами [14]. Эти биологически активные медиаторы обладают способностью стимулировать различные звенья иммунного ответа, особенно гуморальный иммунитет [10]. В состав миелопида входят шесть низкомолекулярных миелопептидов (МП) с молекулярной массой 500-3000 D, выделенных из супернатанта культуры клеток костного мозга свиньи методом твердофазной экстракции. Каждый миелопептид обладает определенным биологическим действием, совокупность которых и обусловливает его клинический эффект. МП-1 восстанавливает нормальный баланс активности Т-хелперов и Т-супрессоров. МП-2 подавляет пролиферацию злокачественных клеток и существенно снижает способность опухолевых клеток продуцировать токсические субстанции, подавляющие функциональную активность Т-лимфоцитов. МП-3 стимулирует активность фагоцитарного звена иммунитета и, следовательно, повышает антиинфекционный иммунитет. МП-4 оказывает влияние на дифференцировку гемопоэтических клеток, способствуя их более быстрому созреванию, т. е. обладает лейкопоэтическим эффектом.
Миелопид нашел применение в клинике для восстановления нормального функционирования иммунной системы при различных патологических состояниях.
Включение миелопида в комплексную терапию хронических неспецифических заболеваний легких существенно улучшает клиническое состояние больных и значительно увеличивает продолжительность ремиссии ( до одного года и более у 78%). Применение миелопида в комплексной терапии гнойно-воспалительных процессов позволяет добиться быстрой и полной санации очага инфекции и увеличивает эффективность действия антибиотиков. Так, у больных, перенесших различные операции на сердце, пневмония и нагноение раны с медиастинитом возникли в 15,5 и 18,9% случаев в контрольной группе, в опытной группе эти осложнения наблюдались у 6,7 и 10,8% соответственно. Следует отметить, что осложнения, развившиеся у больных, получавших миелопид, протекали на фоне менее выраженной интоксикации и лихорадки, умеренного лейкоцитоза и сопровождались незначительным гнойным отделяемым из раны. Клиническое улучшение у больных, получавших миелопид, наступало на 12-14-й день, у больных контрольной группы — на 17-21-й день после операции. Миелопид оказался также эффективным в комплексном лечении переломов нижней челюсти [17].
Иммунологическое исследование показало, что уже на первые-вторые сутки после операции у больных развивается выраженный иммунодефицит, при котором страдают практически все звенья иммунной системы. Проведение сразу после операции иммунотерапии с помощью миелопида приводило к значительному ускорению восстановления всех показателей иммунитета. Количество Т- и В-лимфоцитов и Т-хелперов у таких больных достигало нормальных значений уже на седьмые-восьмые сутки. Также происходило восстановление функциональной активности Т- и В-лимфоцитов, определяемое по способности синтезировать ИЛ-2 и иммуноглобулины соответственно [3].
Патологические состояния, при которых рекомендовано применение полиоксидония: |
|
|
|
Патологические состояния, при которых рекомендуется применение ликопида: |
|
|
|
Патологические состояния, при которых рекомендовано применение миелопида: |
|
|
|
Патологические состояния, при которых применяется иммунофан: |
|
|
|
Травма, так же как и оперативное вмешательство, ведет к развитию иммунодефицита, которое прежде всего проявляется в понижении уровня Т-клеток уже на следующие сутки. Без иммуностимуляции это иммунодефицитное состояние сохранялось в течение трех недель. Применение миелопида вело к существенному улучшению иммунологических показателей: количество Т-лимфоцитов возвращалось к норме на седьмой день. Восстановление иммунологических показателей четко коррелировало с улучшением клинической картины заболевания [17].
Из ИТЛС, полученных из тимуса, в клинической практике нашел применение целый ряд препаратов нескольких поколений. Толчком к их созданию стало открытие нового класса биологически активных соединений — пептидных гормонов тимуса [24]. К ним относится семейство тимозинов, тимопоэтинов и сывороточный тимический фактор — тимулин. Эти тимические пептиды при поступлении в кровь оказывают влияние на всю периферическую иммунную систему, стимулируя рост и пролиферацию лимфоидных клеток. Установление этого факта явилось мощным толчком к созданию ИТЛС тимического происхождения.
К ИТЛС первого поколения относятся препараты, полученные на основе экстрактов ткани тимуса: тактивин, тималин, тимоптин, тимактид и др. Из этих препаратов в хирургической практике наиболее часто используют тактивин, представляющий собой комплекс пептидов, экстрагированных из тимуса крупного рогатого скота [2]. Он является эффективным иммунокорригирующим средством, увеличиваеит число Т-лимфоцитов, которое, как правило, понижается при вторичных иммунодефицитных состояниях, усиливает их функциональную активность, определяемую по способности продуцировать цитокины, стимулирует активность естественных киллеров, стволовых гемопоэтических клеток и нормализует ряд других показателей, характеризующих напряженность Т-клеточного иммунитета [16].
Клиническая эффективность тимических препаратов первого поколения не вызывает сомнения. Но у них есть один недостаток: они представляют собой неразделенную смесь биологически активных пептидов и их достаточно трудно стандартизовать. Прогресс в области ИТЛС тимического происхождения шел по линии создания препаратов 2-го и 3-го поколения, представляющих собой синтетические аналоги естественных гормонов тимуса: альфа-один-тимозина и тимопоэтина или фрагментов этих гормонов, обладающих биологической активностью. Последнее направление оказалось наиболее продуктивным, особенно в отношении тимопоэтина. На основе одного из активных фрагментов, включающего аминокислотные остатки 32-36-тимопоэтина, создан препарат тимопентин, получивший на Западе разрешение на медицинское применение [25], и иммунофан [8], получивший разрешение на медицинское применение в России и представляющий собой синтетический гексапептид, аналог участка 32-36-тимопоэтина. Иммунофан выпускают в ампулах в виде 0,005% по 1 мл.
Изучение механизма действия показало [8], что иммунофан:
- восстанавливает продукцию тимического гормона тимулина (у тимэктомированных мышей — до значений, характерных для нормальных животных);
- усиливает в опытах in vitro и in vivo выработку ИЛ-2 лимфоцитами, стимулированными Т-митогенами;
- оказывает иммуномодулирующее действие на продукцию ФНО, т. е. повышает пониженное и понижает повышенное его образование;
- стимулирует in vitro образование IgG, IgA, IgM, причем стимуляция синтеза IgA происходит в культуре лимфоцитов, полученных от больных селективным IgA-дефицитом;
- ингибирует in vitro образование IgE в культурах лимфоцитов, полученных из периферической крови больных с аллергиями;
- обладает адьювантным эффектом, что проявляется в повышении иммуногенности вакцин против клещевого энцефалита и гепатита А.
При проведении клинических испытаний иммунофан показал себя высоко эффективным средством в плане восстановления нарушенной иммунологической реактивности при хронических бактериальных и вирусных инфекциях, хирургических инфекциях, онкологических заболеваниях [8].
Его применение в комплексном лечении особенно тяжелых послеоперационных осложнений позволило существенно снизить летальность. Так, летальность у больных с нагноившейся гематомой печени, септической пневмонией и перитонитом, не получавших иммунофан, составила 100, 80 и 78%, при применении же в комплексном лечении этих больных иммунофана летальность составила 33, 33 и 50% соответственно. Как правило, у этих пациентов наблюдаются явления дезинтеграции всей иммунной системы. Она проявляется в понижении клеточного иммунитета (снижение всех популяций Т-лимфоцитов и их функциональной активности) и активации гуморального иммунитета (увеличение уровня IgG, IgM и циркулирующих иммунных комплексов) [9]. Применение иммунофана позволило быстро и эффективно нормализовать измененные параметры иммунологической реактивности.
Помимо стимуляции иммунологической реактивности иммунофан обладает выраженной способностью активировать антиоксидантную систему организма. Это проявляется в усилении активности каталазы и синтеза антиоксидантных белков — церулоплазмина и лактоферина. Эти два свойства имунофана позволили рекомендовать его в комплексной терапии онкологических больных не только для повышения иммунитета, но и для элиминации токсических свободнорадикальных и перекисных соединений. Его применение позволило существенно сократить лучевые реакции со стороны клеток белой крови и повысить их функциональную активность.
- Стратегия применения ИТЛС
Как известно, ИТЛС редко используются в виде монотерапии. Основной их сферой применения являются вторичные иммунодефициты, при которых инфекционные агенты играют существенную роль в развитии заболевания. Поэтому в большинстве случаев для лечения этих иммунодефицитов применяются антибактериальные, противогрибковые и противовирусные препараты. Возникает вопрос, как и какие ИТЛС наиболее целесообразно применять в этих случаях? Здесь уместно напомнить, что в конечном итоге гибель большинства как внеклеточных, так и внутриклеточных микробов происходит в фагоцитарных клетках: нейтрофилах или макрофагах. Поэтому при лечении инфекционного компонента иммунодефицита целесообразно использовать те ИТЛС, которые усиливают функциональную активность фагоцитов. К ним относятся практически все основные современные препараты: ликопид, миелопид, полиоксидоний и др. Наиболее целесообразно при лечении инфекционного компонента иммунодефицита назначать ИТЛС одновременно с антибиотиками. При комплексном применении антибиотика и ИТЛС по возбудителю наносится двойной удар: антибиотик существенно подавляет функциональную активность возбудителя и делает его более чувствительным к киллерному эффекту фагоцита, а ИТЛС существенно стимулирует функциональную активность фагоцита, повышая его способность поглощать и убивать возбудителя. Аналогичная ситуация имеет место и при вирусной инфекции: ИТЛС (например, ликопид), повышая цитотоксические свойство макрофагов и NK- клеток, существенно усиливает их способность убивать вирусинфицированные клетки — главный путь диссеминации возбудителя в организме. Здесь также уместно сказать, что, помимо антибиотиков, ликопид хорошо взаимодействует и с препаратами интерферонового ряда и их индукторами. Нанесение тройного удара по возбудителю: противовирусное средство, ликопид и индуктор интерферона, по нашим наблюдениям, является исключительно эффективным при ряде хронических герпетических и цитомегаловирусных инфекциях.
Таким образом, главным принципом применения ИТЛС при лечении инфекционного компонента иммунодефицита является его одновременное назначение с антибактериальными средствами, что значительно повышает клинический эффект.
- Заключение
Суммируя представленный материал, следует отметить, что практически все ИТЛС, применявшиеся в лечебной практике, показали неплохой эффект в плане лечения и профилактики вторичных иммунодефицитов. Эра иммунокорригирующей терапии с помощью ИТЛС только началась, и широкое клиническое внедрение препаратов этого профиля в будущем позволит уточнить, дополнить и, может быть, значительно расширить (или ограничить) спектр их применения, схемы и дозировки. Как известно, практика — лучший критерий истины.
При применении ИТЛС с лечебной целью следует всегда помнить о двух правилах иммунокорригирующей терапии: она, как правило, входит в состав комплексного лечения и обязательным условием ее проведения является оценка иммунного статуса до и после лечения.
Наличие довольно большого числа ИТЛС не должно пугать практических врачей. Иммунная система состоит из ряда тесно связанных в функциональном плане компонентов, задача которых заключается в элиминации из организма чужеродных веществ антигенной природы. У каждого из компонентов этой системы могут быть свои относительно специфические агенты, модулирующие уровень их активности. В то же время следует помнить, что иммунная система работает по принципу системы мобилей [12]: активация одного из ее компонентов с помощью ИТЛС ведет к активации других участников системы, вследствие чего и получается положительный клинический эффект при использовании практически всех ИТЛС.
Литература
1. Андронова Т. М., Иванов В. Т. The structure and immunolocical function of glucosaminylmuramyl peptides. Sov. Medic. Rev. D. Immunology. Harwood Acad. Publ. 1991, 4, 1–63.
2. Арион В. Я. Иммунологически активные факторы тимуса. В кн.: Итоги науки и техники. Серия. Иммунология. М., 1981, т. 9.
3. Богомолова Н. С., Аббакумов Р. Н., Степаненко Р. Н и др. Иммунокорригирующее действие миелопида у больных после операции на сердце в условиях искусственного кровообращения. Иммунология, 1991, №1, с. 55–58.
4. Винницкий Л. И., Бунатян К. А. Иммунологические проблемы в хирургической практике. Иммунологический мониторинг патологических состояний и иммунореабилитация. Тез. докл. всеросс. конф. М., 1995, с. 143–144.
5. Винницкий Л. И., Бунатян К. А., Пинегин Б. В. и др. Отечественный иммуномодулятор нового поколения ликопид в комплексном лечении и профилактике инфекционных осложнений в хирургической практике. Вестник РАМН, 1997, №11, с. 46–48.v 6. Иванов В. Т., Хаитов Р. М., Андронова Т. М., Пинегин Б. В. Ликопид (глюкозаминилмурамилдипептид) — новый отечественный высокоэффективный иммуномодулятор для лечения и профилактики заболеваний, связанных со вторичной иммунологической недостаточностью. Иммунология, 1996, 2,4–6.
7. Лазарева Д. Н., Алехин Е. К. Стимуляторы иммунитета. М.: Медицина, 1985.
8. Лебедев В. В., Шелепова Т. М., Степанов О. Г. и др. Иммунофан — регуляторный пептид в терапии инфекционных и неинфекционных болезней. М.: Изд. Праминко, 1998, с. 119.
9. Максимов С. Л., Лебедев В. В., Иванушкин, Кокорева Л. Н. Изменение некоторых показателей клеточного иммунитета у больных ХАГ и ХПГ и возможности выбора иммунокорригирующей терапии. Материалы IV Всесоюзного съезда гастроэнтерологов. М., 1990, т. 2, с. 169–171.
10. Михайлова А. А. Индивидуальные миелопептиды — лекарства «нового поколения», используемые для иммунореабилитации. Int. J. Immunoreabilit. 1996, 2, с. 27–31.
11. Патютко М. Ю. Клинико-иммунологическая оценка применения нового иммуномодулятора «полиоксидоний» в комплексной терапии гнойно-септических осложнений у хирургических больных. Автреф. канд. дис. М. 1996.
12. Петров Р. В. Я или не я. Иммунологические мобили. М.: Молодая гвардия, 1987.
13. Петров Р. В., Хаитов Р. М., Атауллаханов Р. И. Иммуногенетика и искусственные антигены. М.: Медицина, 1983.
14. Петров Р.В., Михайлова А. А., Захарова Л. А. и др. Myelopeptides -bone marrow mediators with immunostimulating and endorphinlike activity. Scand. J. Immunol., 1986, 24, 237–243.
15. Петров Р. М., Хаитов Р. М. Искусственные антигены и вакцины. М. Медицина, 1988.
16. Cоловьев Г. М., Петрова И. В., Ковалев С. В. Иммунокоррекция, профилактика и лечение гнойно-септических заболеваний. М.: Медицина, 1987.
17. Степаненко Р. Н., Рязанов Н. К., Молдокулов О. А., Власенко Р. Я. Миелопид: иммунокорригирующая активность при переломах лицевых костей и травматическом остеомиелите. Иммунология. 1991, 1, с. 44–47.
18. Хаитов Р. М., Иванова А. С., Некрасов А. В., Патютко М. Ю. Результаты применения нового иммуномодулятора полиоксидония у больных с послеоперацинными гнойно-септическими процессами. В кн: Актуальные проблемы клинической иммунологии. Сочи, 1994, с. 109.
19. Хаитов Р. М., Пинегин Б. В., Бутаков А. А. и др. Иммунотерапия инфекционных послеоперационных осложнений с помощью нового иммуностимулятора ликопида. Иммунология, 1994, 2, с. 47-50.
20. Хаитов Р. М., Пинегин Б. В. Иммуномодуляторы и некоторые аспекты их клинического применения. Клиническая медицина, 1996, 8, с. 7–13.
21. Хаитов Р. М., Пинегин Б. В., Бутаков А. А., Андронова Т. М. Immunotherapy of infectious postoperative complications with glucosaminylmuramyl dipeptide. Immunotherapy of Infectious. Ed. N. Masihi. Marcel Dekker, Inc. N.Y., Basel, Hong Kong, 1994, 205–211.
22. Adam A., Lederer e. Muramyl peptides: immunomodulators, sleep factors and vitamins. Med. Mes. Rev.1984, 4, p. 111–152.
23. Ellouz F., Adam A., Cioburi R., Lederer E. Minimal structural requirements for adjuvants activity of bacterial peptidoglycan derivates. Biochem. Biophys. Commun., 1974, 59, p. 1317–1325.
24. Goldstein A. L., Thurman G. B., Cohen G. N., Hooper J. A. Thymosin: chemistry, biology and clinical application. In: Biol. Activities of Thymic Hormones. Ed. DW van Bekkeim. Rotterdam, 1975, p. 173.
25. Hadden J. W. Immunostimulants. Immunol. Today, 1993, 14, p. 275–280.
Патогенетической основой большинства заболеваний органов дыхания является воспалительный процесс, вызванный различными причинами. В свою очередь, воспаление вызывает местные нарушения, как тканевые, так и иммунные, обусловленные продуктами секреции патогенов. Иммунные нарушения выражаются в снижении функциональной способности клеток защиты, ослаблении различных звеньев гуморального иммунитета. Само воздействие инфекционного агента часто становится причиной вторичного угнетения иммунитета. При этом традиционно применяемые в лечении пульмонологических больных лекарственные средства (антибиотики, противогрибковые препараты, стероидные гормоны и др.) не всегда оправдывают возлагаемые на них надежды. Так, например, широко известно о развитии резистентности микроорганизмов к противомикробным препаратам, многочисленных побочных эффектах антибиотиков и стероидных гормонов, в том числе и о возможном развитии вторичной иммуносупрессии. Поэтому возникает необходимость включения современных, высокоэффективных иммунокорректоров в комплексные схемы лечения больных пульмонологического профиля.
В качестве иммуномодулируюшего средства нами был выбран препарат Полиоксидоний. В основе его механизма действия лежит прямая активация фагоцитирующих клеток и естественных киллеров, усиление взаимодействия между Т– и В–лимфоцитами, активация антителообразования. При этом Полиоксидоний не влияет на показатели, находящиеся в пределах нормальных значений, не нарушает естественных механизмов торможения иммунных реакций, не истощает резервных возможностей кроветворной системы. Полиоксидоний можно назначать больным как с выявленными, так и с невыявленными нарушениями иммунного статуса, основываясь на клинических данных. Наряду с иммуномодулирующими свойствами Полиоксидоний обладает еще и дезинтоксикационными и антиоксидантными свойствами, а также активирует репаративные и регенераторные процессы. Важной особенностью Полиоксидония, отличающей его от других иммуномодуляторов, является то, что его можно применять как для лечения острых, так и хронических инфекционных процессов различной этиологии, а также при атопических заболеваниях. Данные свойства препарата обусловили наш выбор использования его у больных с бронхолегочной патологией.
Полиоксидоний применялся нами в дополнение к комплексной терапии, проводимой в соответствии с принятыми стандартами лечения. В исследование были включены 89 чел. в возрасте от 32 до 68 лет, из них мужчин – 60,7%, женщин – 39,3%. Исследуемая группа больных представлена следующими заболеваниями органов дыхания: хроническая обструктивная болезнь легких – 25 чел. (28,1%), бронхиальная астма – 38 чел. (42,7%), бронхоэктатическая болезнь – 24 чел. (27%), бронхолегочный аспергиллез – 2 чел. (2,2%). У 22 чел. (35% больных первых двух групп) выявлена грибковая суперинфекция бронхов.
В 64% случаев у пациентов, кроме бронхолегочных заболеваний, имелась сопутствующая патология, а именно: язвенная болезнь 12–перстной кишки, гастроэзофагальнорефлюксная болезнь, дисбактериоз кишечника, гипертоническая болезнь, миокардиодистрофия, грибковое поражение кожи.
Способы введения Полиоксидония определялись конкретной клинической ситуацией. Пациенты получали препарат внутривенно капельно по 6–12 мг до 5 инъекций на курс (23 случая), внутримышечно по 6 мг до 5–10 инъекций на курс (13 случаев), эндобронхиально по 6–12 мг, на курс 1–2 процедуры (53 случая). В 17 случаях было сочетание различных способов введения препарата (внутривенного и эндобронхиального). Эндобронхиальный способ введения возможен благодаря тому, что Полиоксидоний хорошо растворяется в физрастворе, быстро распределяется в тканях организма и не вызывает местнораздражающего действия. Эндобронхиальное введение проводилось в виде заливок раствора препарата в дозе 6 мг в бронхи, а также по известной методике введения 6 мг Полиоксидония, растворенного 3 мл физраствора в карину трахеи.
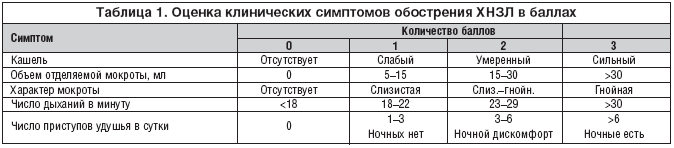
Для сравнения взята группа больных, сопоставимая с исследуемой по численности, нозологиям, тяжести течения, возрасту и полу. Динамика состояния пациентов оценивалась по клиническим показателям, данным лабораторных, биохимических, рентгенологического, бактериологического, эндоскопического, цитологического методов исследования. Сравнивалась полнота терапевтического действия, время нормализации показателей, переносимость лечения у пациентов изучаемой и контрольной групп. Оценку основных клинических симптомов обострения заболевания (кашель, одышка, объем и характер мокроты, наличие удушья) осуществляли в баллах (табл. 1), по аналогии с критериями, предложенными N. Anthonisen (1987).
Пациенты исследуемой и контрольной групп получали стандартную терапию, соответствующую диагнозу и тяжести течения заболевания.
Результаты терапии оценивались по данным инструментального обследования пациентов, по выраженности клинических симптомов (в баллах) и по темпам их регрессии (в днях). Статистическая обработка данных проводилась с использованием методов вариационной статистики.
Как показали проведенные нами наблюдения, в группе пациентов, получавших в составе комплексной терапии Полиоксидоний, отмечались более быстрое улучшение самочувствия, повышение физической активности, положительная динамика в симптоматике основного и сопутствующих заболеваний. Все больные хорошо переносили введение препарата. Лишь в трех случаях эндобронхиального введения отмечались кратковременный субфебрилитет, тахикардия, транзиторное повышение артериального давления, что расценено нами, как общая реакция организма на процедуру; при этом бронхоспазма не зафиксировано ни в одном случае наблюдения, при любом способе введения препарата.
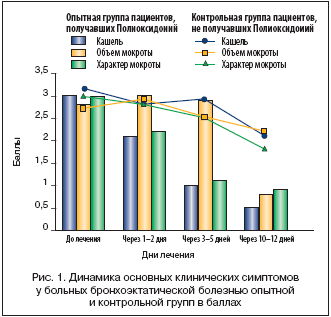
Отслеживая клинические эффекты Полиоксидония при различных нозологиях, можно отметить следующее: наиболее отчетливый результат в нашем исследовании получен при назначении Полиоксидония больным с обострением бронхоэктатической болезни. Численность этой группы – 24 человека, возраст от 32 до 65 лет, из них мужчин 66,7%, женщин 33,3%. Следует отметить, что больные исследуемой и контрольной групп имели длительный «стаж» болезни, неоднократные обострения, требующие стационарного лечения и применения различных антибиотиков. Полиоксидоний в исследуемой группе больных назначался в дозе 6–12 мг в виде внутривенных инфузий (5 процедур на курс) в случаях и (или) путем эндобронхиального введения (1–2 процедуры на курс) в 20 случаях; в 7 случаях было сочетание обоих способов введения. Изменение основных клинических симптомов оценивалось в балльной системе (согласно представленной таблице 1) до начала терапии, через 1– 2 дня, 3–5 и 10–12 дней от начала лечения. Результаты клинического наблюдения представлены на рисунке 1, где столбцы диаграммы отражают выраженность отдельных клинических симптомов (в баллах) у пациентов исследуемой группы, получавших Полиоксидоний, а графики – выраженность тех же симптомов (в баллах) у пациентов контрольной группы, не получавших этот препарат.
Как видно из представленных графиков и диаграмм, у пациентов исследуемой группы отмечается более выраженное и быстрое уменьшение кашля и «гнойности» мокроты по сравнению с контрольной группой. Объем мокроты остается значительным в первые дни лечения, к 10–12 дню – существенно уменьшается по сравнению с контрольной группой. Таким образом, в данном случае к положительным эффектам Полиоксидония следует отнести более быстрое и выраженное уменьшение клинических симптомов воспаления, улучшение бронхиального дренажа. Указанная закономерность подтверждалась результатами лабораторных, бактериологических и эндоскопических исследований. Обращал на себя внимание и быстрый дезинтоксикационный эффект, буквально с первой процедуры введения препарата. Все это дало возможность снизить дозы антибактериальных препаратов при проведении необходимой санации бронхиального дерева. Указанные положительные эффекты действия Полиоксидония с разной степенью выраженности отмечались в 100% случаев у наблюдаемых нами пациентов исследуемой группы с бронхоэктатической болезнью.
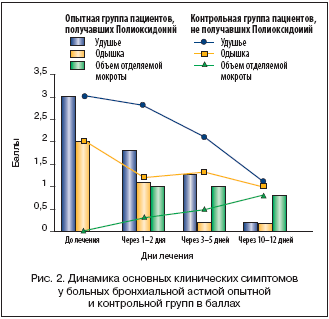
Другую исследуемую группу составили пациенты с бронхиальной астмой (23 женщины, 15 мужчин) в возрасте от 38 до 60 лет, все с полисенсибилизацией. Длительность заболевания составляла 10 и более лет. В качестве базисной противовоспалительной терапии применялись умеренные дозы системных и ингаляционных глюкокортикостероидов в течение 8 и более лет. Кроме того, всех больных данной группы характеризовало торпидное течение болезни, с частыми обострениями, у большинства имелись побочные эффекты глюкокортикоидной терапии (кушингоидный синдром, остеопороз). В 31,5% случаев у пациентов имело место присоединение слизистого и кожного кандидоза, требующего добавления к терапии противомикотических средств. Полиоксидоний назначался в дозе 6 мг внутривенно капельно – 19 случаев, внутримышечно – 6 случаев, эндобронхиально (1–2 процедуры на курс) – 20 случаев, в 7 случаях было сочетание разных способов введения. При этом ухудшения в течении астматического процесса, проявлений лекарственной непереносимости зафиксировано не было. В целом положительный эффект наблюдался нами в 81,6% случаев. В 18,4% достоверных клинико–функциональных изменений не было. Динамика основных клинических симптомов до лечения и в процессе наблюдения также оценивалась в балльной системе (табл. 1). Результаты клинического наблюдения исследуемой группы сведены в график/диаграмму, представленную на рисунке 2. Здесь столбцы диаграммы отражают показатели исследуемой группы, а графики – показатели контрольной группы (в баллах).
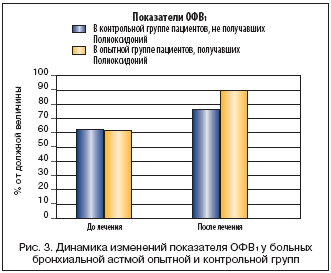
Как видно из рисунка 2, на фоне введения Полиоксидония достигается более полный и быстрый «эффект стихания воспаления», наблюдается увеличение отделяемой мокроты за счет улучшения бронхиального дренажа, улучшается бронхиальная проходимость. Более объективно улучшение бронхиальной проходимости в процессе лечения отражают показатели спирометрии (в частности, ОФВ1) у больных бронхиальной астмой опытной (получавших Полиоксидоний) и контрольной групп (рис. 3).
Быстрое стихание воспалительных изменений, уменьшение явлений гиперактивности бронхов у пациентов исследуемой группы привело к возможности снижения поддерживающей дозы глюкокортикоидов, уменьшения потребности в b2–aгонистах без ухудшения состояния больных.
В группе пациентов с хронической обструктивной болезнью легких, которым назначался Полиоксидоний, было 25 чел., из них мужчин 92%. Эта группа представлена больными со среднетяжелым и тяжелым течением болезни, имеющими дыхательную недостаточность II степени. Заболевание протекало с частыми обострениями, требующими стационарного лечения, с неоднократными курсами антибактериальной, противовоспалительной и постоянной бронхолитической терапии. В 40% случаев наблюдений течение заболевания осложнялось присоединением грибковой суперинфекции бронхов (кандидоз слизистых). Этим больным в комплексе с традиционно применяемыми лекарственными средствами был назначен Полиоксидоний в виде внутримышечных инъекций (7 случаев), внутривенных инфузий (8 случаев), и эндоскопически (13 случаев); в 3–х случаях было сочетанное введение препарата разными путями.
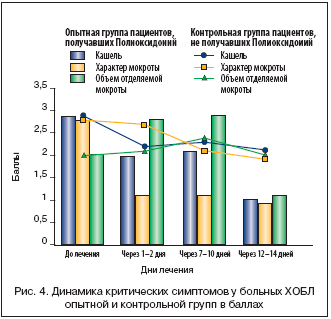
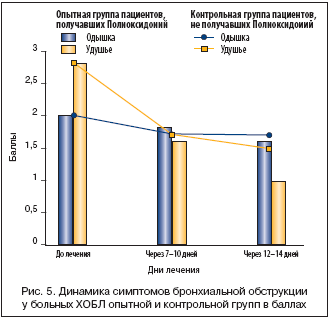
Для анализа эффективности препарата в балльной системе (табл. 1) оценивались основные клинические симптомы (кашель, объем и характер мокроты, одышка и число приступов удушья) до начала и в процессе лечения по дням наблюдения: 1–2, 7–10, 12–14–й дни. Результаты клинических наблюдений сведены в графики/диаграммы (рис. 4, 5).
Оценивая результаты исследования (рис. 4), можно отметить, что при назначении Полиоксидония у больных с ХОБЛ быстрее и отчетливее уменьшается кашель, буквально на 2–3–й день от начала терапии меняется характер мокроты с гнойной, слизисто–гнойной на слизистую, а объем мокроты даже увеличивается по сравнению с контрольной группой.
Таким образом, назначение Полиоксидония приводит к улучшению бронхиального дренажа, дает более полный противовоспалительный эффект, приводящий к возможности санации бронхов без применения антибиотиков или с их короткими курсами.
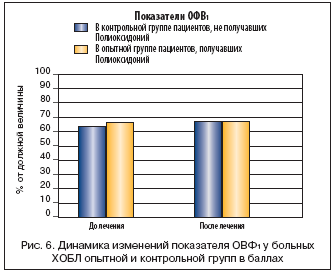
Как видно из рисунка 5, симптомы, отражающие дыхательные нарушения, за 12–14 дней наблюдения менялись мало. Больные исследуемой группы отмечали улучшение общего самочувствия, повышение устойчивости к привычным физическим нагрузкам, но объективные функциональные показатели спирометрии практически остались прежними (рис. 6).
В целом в группе больных с хронической обструктивной болезнью легких в 92% наблюдений эффект от применения Полиоксидония оценивался как положительный, различной степени выраженности. Ни субъективного, ни объективного ухудшения в состоянии пациентов этой группы при применении Полиоксидония зафиксировано не было.
Проводилось изучение зависимости выраженности терапевтического действия Полиоксидония от способа его введения в организм (табл. 2). Лечебные свойства препарата, а именно – противовоспалительное действие, дезинтоксикационный эффект, усиление противомикробного действия антибактериальных препаратов, улучшение бронхиального дренажа, возможность снижения дозы других лекарственных средств оцениваем по 5–балльной системе: (–) – нет эффекта. (+–) – сомнительный эффект, (+) – достоверно положительный эффект, (++) – значительный эффект, (+++) – максимально выраженный эффект. Результаты приведены в таблице 2.
По нашим наблюдениям, для достижения клинически значимого эффекта нет необходимости в продолжительных курсах применения препарата. Уже при первых введениях Полиоксидония отмечаются изменения в клиническом состоянии пациентов, а при эндобронхиальном способе достаточно 1–2 процедур для получения значимого результата. При инъекционных способах введения на курс достаточно 5–10 процедур. При всех способах введения побочных эффектов не наблюдалось, в том числе и у пациентов с атоническими заболеваниями.
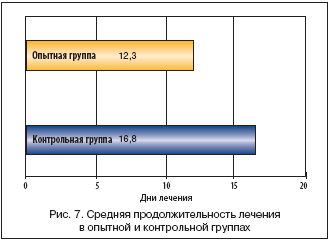
Быстрота наступления терапевтического эффекта, полифункциональность воздействия на состояние бронхолегочной системы и организма в целом, короткая продолжительность курса введения, отсутствие побочных эффектов при назначении Полиоксидония – все это значительно повышает эффективность стандартной терапии, сокращает время пребывания больного в стационаре (рис. 7).
Таким образом, применение Полиоксидония в лечении заболеваний органов дыхания высокоэффективно, целесообразно и позволяет оптимизировать схемы противовоспалительной терапии хронических неспецифических заболеваний легких.
Активное вещество: Полиоксидоний® (Азоксимера бромид) — 3 мг или 6 мг Вспомогательные вещества: маннитол, повидон, бетакаротен — до 4,5 мг для дозировки 3 мг или до 9 мг для дозировки 6 мг.
пористая масса от белого цвета с желтоватым оттенком до желтого цвета. Препарат гигроскопичен и светочувствителен.
Полиоксидоний обладает иммуномодулирующим действием, увеличивает резистентность организма в отношении локальных и генерализованных инфекций. Основой механизма иммуномодулирующего действия препарата Полиоксидоний® является прямое воздействие на фагоцитирующие клетки и естественные киллеры, а также стимуляция антителообразования.
Полиоксидоний® восстанавливает иммунитет при вторичных иммунодефицитных состояниях, вызванных различными инфекциями, травмами, ожогами, аутоиммунными заболеваниями, злокачественными новообразованиями, осложнениями после хирургических операций, применения химиотерапевтических средств, цитостатиков, стероидных гормонов.
Наряду с иммуномодулирующим действием, Полиоксидоний® обладает выраженной детоксикационной и антиоксидантной активностью, обладает способностью выводить из организма токсины, соли тяжелых металлов, ингибирует перекисное окисление липидов. Указанные свойства определяются структурой и высокомолекулярной природой препарата Полиоксидоний®. Включение его в комплексную терапию онкологических больных уменьшает интоксикацию на фоне химио- и лучевой терапии, в большинстве случаев позволяет проводить стандартную терапию без изменения схемы в связи с развитием инфекционных осложнений и побочных эффектов (миелосупрессия, рвота, диарея, цистит, колит и другие).
Применение препарата Полиоксидоний® на фоне вторичных иммунодефицитных состояний позволяет повысить эффективность и сократить продолжительность лечения, значительно уменьшить использование антибиотиков, бронхолитиков, глюкокортикостероидов, удлинить срок ремиссии.
Препарат хорошо переносится, не обладает митогенной, поликлональной активностью, антигенными свойствами, не оказывает аллергизирующего, мутагенного, эмбриотоксического, тератогенного и канцерогенного действия.
При внутримышечном введении Полиоксидоний имеет высокук (89%); время достижения максимальной концентрации в крови — 41 распределяется по всем органам и тканям.
В организме препарат гидролизуется до олигомеров, которые выводятся преимущественно почками.
Коррекция иммунитета у взрослых и детей от 6 месяцев.
У взрослых в комплексной терапии:
• хронических рецидивирующих инфекционно-воспалительных заболеваний, не поддающихся стандартной терапии в стадии обострения и в стадии ремиссии;
• острых и хронических вирусных и бактериальных инфекций (в том числе урогенитальных инфекционно-воспалительных заболеваний);
• туберкулеза;
• острых и хронических аллергических заболеваний (в том числе поллиноза, бронхиальной астмы, атопического дерматита), осложненных хронической рецидивирующей бактериальной и вирусной инфекцией;
• в онкологии в процессе и после химио- и лучевой терапии для снижения иммуносупрессивного, нефро — и гепатотоксического действия лекарственных препаратов;
• для активации регенераторных процессов (переломы, ожоги, трофические язвы);
• ревматоидного артрита, длительно леченного иммуно депрессантами; при осложненном ОРЗ течении ревматоидного артрита;
• для профилактики послеоперационных инфекционных осложнений;
• для профилактики гриппа и ОРЗ
У детей в комплексной терапии:
• острых и хронических воспалительных заболеваний, вызванных возбудителями бактериальных, вирусных, грибковых инфекций (в т.ч. ЛОР-органов — синусита, ринита, аденоидита, гипертрофии глоточной миндалины, ОРВИ);
• острых аллергических и токсико-аллергических состояний;
• бронхиальной астмы, осложненной хроническими инфекциями респираторного тракта;
• атопического дерматита, осложненного гнойной инфекцией;
• дисбактериоза кишечника (в сочетании со специфической терапией);
• для реабилитации часто и длительно болеющих;
• профилактики гриппа и ОРЗ.
Повышенная индивидуальная чувствительность. Беременность, лактация (клинический опыт применения отсутствует).
Острая почечная недостаточность, детский возраст до 6 месяцев (клинический опыт применения ограничен).
Способы применения препарата Полиоксидоний®: парентеральный, интраназальный. Способы применения выбираются врачом в зависимости от тяжести заболевания и возраста больного.
Внутримышечно или внутривенно (капельно): препарат назначают взрослым в дозах 6- 12 мг 1 раз в сутки ежедневно, через день, или 1-2 раза в неделю в зависимости от диагноза и тяжести заболевания.
Реополиглюкина или 5 % раствора декстрозы, затем стфильно переносят во флакон с указанными растворами объемом 200-400 мл.
Приготовленный раствор для парентерального введения хранению не подлежит. Интраназально: дозу 6 мг растворяют в 1 мл (20 капель) дистиллированной воды, 0,9 % раствора хлорида натрия или кипяченой воды комнатной температуры.
Рекомендуемые схемы лечения взрослых
Парентерально:
При острых воспалительных заболеваниях: по 6 мг ежедневно в течение 3-х дней, далее через день общим курсом 5-10 инъекций.
При хронических воспалительных заболеваниях: по 6 мг через день 5 инъекций, далее 2 раза в неделю курсом не менее 10-инъекций.
При туберкулезе: по 6-12 мг 2 раза в неделю курсом 10-20 инъекций.
У больных острыми и хроническими урогенитальными заболеваниями: по 6 мг через день курсом 10 инъекций в сочетании с химиопрепаратами.
При хроническом рецидивирующем герпесе: по 6 мг через день курсом 10 инъекций в сочетании с противовирусными препаратами, интерферонами и/или индукторами синтеза интерферонов.
Для лечения осложненных Форм аллергических заболеваний: по 6 мг, курс 5 инъекций: две первые инъекции ежедневно, затем через день. При острых аллергических и токсико-аллергических состояниях вводить внутривенно по 6-12 мг в сочетании с противоаллергическими препаратами.
При ревматоидном артрите: по 6 мг через день 5 инъекций, далее 2 раза в неделю курсом не менее 10 инъекций.
У онкологических больных:
— до и на фоне химиотерапии для снижения иммунодепрессивного, гепато- и нефротоксического действия химиотерапевтических средств по 6-12 мг через день курсом не менее 10 инъекций; далее частота введения определяется врачом в зависимости от переносимости и длительности химио- и лучевой терапии;
— для профилактики иммунодепрессивного влияния опухоли, для коррекции иммунодефицита после химио- и лучевой терапии, после хирургического удаления опухоли показано длительное применение препарата Полиоксидоний® (от 2-3 месяцев до 1 года) по 6-12 мг 1-2 раза в неделю.
Интраназально назначают по 6 мг в сутки для лечения острых и хронических инфекций JIOP-органов, для усиления регенераторных процессов слизистых оболочек, для профилактики осложнений и рецидивов заболеваний, для профилактики гриппа и ОРЗ. По 3 капли в каждый носовой ход через 2-3 часа (3 раза в сутки) в течение 5-10 суток.
Особые категории пациентов Лица пожилого возраста: по 6 мг через день 5 инъекций, далее 2 раза в неделю курсом не менее 10 инъекций.
Пациенты с нарушением функции почек: при наличии острой почечной недостаточности препарат назначают не чаще чем 2 раза в неделю.
Пациенты с нарушением функции печени: клинические исследования не проводились
Возможна болезненность в месте инъекции при внутримышечном введении.
Полиоксидоний® совместим с антибиотиками, противовирусными, противогрибковыми и антигистаминными препаратами, бронхолитиками, глюкокортикостероидами, цитостатиками.
При болезненности в месте инъекции препарат растворяют в 1 мл 0,25 % раствора прокаина в случае отсутствия у больного повышенной индивидуальной чувствительности на прокаин. При внутривенном (капельном) введении не следует растворять в белоксодержащих инфузионных растворах.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ И ДРУГИМИ МЕХАНИЗМАМИ
Не изучалось.
Лиофилизат для приготовления раствора для инъекций и местного применения по 4,5 мг (для дозировки 3 мг), по 9 мг (для дозировки 6 мг) в ампулах или флаконах из стекла 1 гидролитического класса. По 5 ампул или флаконов в контурную ячейковую упаковку. По одной контурной ячейковой упаковке вместе с инструкцией по применению в пачку из картона коробочного или по 5 ампул или флаконов вместе с инструкцией по применению в пачку из картона коробочного со вставкой из картона коробочного.
По 50 ампул или флаконов вместе с 10 инструкциями по применению в коробку с перегородками из картона (для стационаров).
В сухом, защищенном от света, недоступном для детей месте, при температуре от 4 до 8 °С.
2 года. Не использовать по истечении срока годности, указанного на упаковке.