Решили установить новую металлическую дверь, но не доверяете сторонним монтажникам? Никаких проблем! С выполнением всех необходимых мероприятий можно справиться собственными силами. Ознакомьтесь с представленным руководством и приступайте.
Размеры новой двери: важные нюансы
Чтобы монтажные работы прошли максимально быстро и с минимальными неудобствами, еще на этапе выбора новой металлической двери внимательно отнеситесь к выполнению необходимых замеров.
Прежде чем отправляться в магазин, замерьте дверной проем. Эта работа осложняется наличием довольно толстого слоя раствора по периметру и, конечно же, дверной коробки. Из-за них четко определить границы проема достаточно сложно, что доставляет ряд неудобств в процессе замера и может исказить его результаты.
Чтобы замеры прошли максимально успешно и точно, ознакомьтесь со следующими рекомендациями:
- перед непосредственной установкой конструкции нижнюю часть проема освобождаем вплоть до пола. Материал, за счет которого приподнята лутка, а также порожки и прочие элементы будут демонтированы;
- верх дверного проема увеличивать, т.е. поднимать, запрещается;
- боковые части при необходимости могут быть несколько расширены. Здесь важно определить ширину опорного поперечного элемента, одновременно являющегося верхней гранью дверного проема. Ширина устанавливаемой двери должна быть примерно на 2-2,5 см меньше аналогичного параметра опорного элемента.
Исходя из вышесказанного, коробка новой металлической двери должна быть на 4-5 см ниже и уже, чем проем.
После снятия необходимых мерок, переходите к подготовке рабочего инструментария.
Набор для работы
- Перфоратор.
- Рулетка для измерений.
- Кувалда.
- Болгарка.
- Пила.
- Деревянная доска.
- Молоток.
Дополнительно вам необходимо подготовить материал для заполнения зазоров между стенами проема и коробкой новой металлической двери. Можете использовать цементный раствор либо монтажную пену. Пена более удобна в обращении.
Также подготовьте крепежные элементы. Традиционно применяются арматурные стержни диаметром 1-1,2 см либо же металлические анкера.
Подготовка проема к установке новой двери
Приступаем к демонтажу старой двери. На данном этапе особо не осторожничаем. Стараемся лишь не разрушить стены, если нет необходимости в расширении дверного проема. В особенности аккуратно нужно работать со стенами из кирпича и пеноблоков.
Снимаем старое полотно либо откручиваем петли с лутки, в соответствии с особенностями конструкции двери.
Пилой либо шлифмашинкой делаем несколько надпилов по периметру дверной коробки, а затем вынимаем ее из проема при помощи лома.
Перфоратором очищаем периметр проема от излишков старой штукатурки и цементного раствора.
На этой стадии особое внимание уделяем низу дверного проема. Нередко после демонтажа коробки в нижней части проема обнаруживается сгнивший деревянный брус либо отслужившая свое кладка. От испорченных элементов избавляемся, а на их место выкладываем новый кирпич либо же фиксируем брус требуемой высоты.
После установки новая металлическая дверь должна находиться на одном уровне с полом коридора. При этом важно учитывать, будет ли пол в дальнейшем заливаться стяжкой или такая работа не предусмотрена.
Основная часть монтажа
На этой стадии заручаемся поддержкой помощника – в одиночку правильно смонтировать металлическую дверь невозможно.
Читайте также про реставрацию дверей своими руками с пошаговой инструкцией, в нашей новой статье.
Устанавливаем коробку в дверной проем и с помощью уровня проверяем возможность ее вертикального монтажа. Проверяем по всем плоскостям, лучше в нескольких местах. Обычно достаточно сделать следующее:
- проверить вертикальную стойку по внутреннему торцу;
- проверить одну из соседних сторон;
- проверить нижнюю перегородку.
Важно, чтобы индикаторы показали полное совпадение во всех точках проверки. Если в каком-то месте стена проема мешает установить дверную коробку ровно, избавьтесь от лишнего элемента при помощи стамески, шлифмашинки, перфоратора или другого подходящего приспособления.
Обеспечив ровность положения коробки, зафиксируйте ее с помощью колышков. Фиксацию лучше выполнять с применением двух подкладок на каждое место. Одну деревянную подкладку делайте толщиной на 0,5 см меньше, чем зазор между коробкой и стеной, а вторую изготавливайте в форме клина. При этом вторую часть клина нужно сделать гораздо длиннее первой, соблюдая малый угол скоса. Это позволит вам легче и быстрее выставить коробку по уровню.
Полезный совет: от использования «дедовского» способа временной фиксации дверной коробки с помощью гвоздей лучше воздерживаться, т.к. он ненадежный. Коробка может попросту сместиться.
Выставив коробку по уровню, приступаем к ее креплению. Фиксация двери может выполняться с применением нескольких способов. Конкретный вариант выбирается с учетом особенностей конструкции двери.
Важно: вне зависимости от выбранного метода крепления, на каждой боковой стороне должно присутствовать минимум три точки фиксации, а на нижней и верхней – от двух.
Сначала крепим сторону коробки с петлями. Фиксировать начинаем с самой верхней точки. Обязательно проверяем правильность установки уровнем после создания каждой точки крепления.
Закрепив сторону коробки с петлями, навешиваем металлическое полотно и еще раз корректируем положение коробки. Обязательно проверяем отсутствие избыточных натяжений и любого рода деформаций коробки.
Убедившись в отсутствии упомянутых проблем, снимаем полотно, фиксируем другую сторону и перемычки коробки. На каждом этапе проверяем правильность монтажа с помощью уровня.
Ознакомьтесь с изготовлением дверей своими руками и инструкцией, из нашей новой статьи.
Варианты фиксации дверной коробки
Ранее упоминалось, что крепление коробки может выполняться несколькими способами. Всего применяется 3 основных метода.
Крепление за проушины
Самый распространенный вариант крепления. Коробка крепится за проушины с помощью штырей либо анкеров. У металлических дверей нового образца проушины приварены к коробке.
Фиксация выполняется в следующем порядке:
- сквозь отверстие в проушине перфоратором в стене создается 10-15-сантиметровое углубление;
- в подготовленное углубление вставляется штырь либо анкер. Штырь нужно предварительно подготовить. Для этого достаточно взять арматуру диаметром порядка 1 см, немного заострить один ее край, а второй расплющить при помощи молотка, сформировав головку;
- крепеж вбивается в углубление до упора;
- штырь скрепляется с проушиной сваркой, анкер подтягивается торцевым ключом.
Крепление сквозь коробку
Порядок действий такой же, как и в предыдущем способе, но отверстия для крепежных элементов создаются прямо в торце металлической коробки.
Крепление «захватом»
Также хорошо подходит для монтажа металлической двери. Коробка крепится наружной окаемкой к проему, а с внутренней стороны приваривается зацеп для скрепления со стеной.
Этот метод оптимально подходит для строений с монолитными стенами и избавляет от необходимости сверления отверстий.
Последние штрихи
После закрепления коробки навешиваем полотно и убеждаемся в правильности его хода. Для этого сначала открываем дверь примерно на 45 градусов, а после на 90. Важно, чтобы в этих положениях полотно не двигалось самопроизвольно.
Убеждаемся в отсутствии люфтов при закрытом состоянии металлической двери. Если проблем нет, приступаем к заполнению зазоров между стенами и коробкой.
Для заделки можно применять пену либо цементный раствор с добавлением алебастра. С пеной работать легче и быстрее. Однако раствор характеризуется более высокой прочностью.
Выбранным материалом заполняем все зазоры. Для заполнения пеной используем специальный пистолет. В случае же использования цементного раствора его лучше всего распределять руками, а не шпателем или мастерком. Консистенция цементного раствора должна быть такой, чтобы он не плыл. Лучший вариант – рыхлое состояние, напоминающее творожную массу.
Проверяем работу замков. По периметру новой двери наклеиваем уплотнитель. Закрепляем наружные наличники. Для их фиксации используем болты либо заклепки.
Процесс самостоятельной установки новой металлической двери почти закончен. Вам остается лишь оформить откосы с внутренней стороны дверного проема на свое усмотрение (штукатуркой, пластиком, гипсокартоном и т.д.). Они позволят скрыть крепежи и придать композиции нормальный внешний вид.
Узнайте ответ на вопрос чрезвычайной важности — какую выбрать входную дверь в квартиру, из нашей новой статьи.
Удачной работы!
Цены на входные двери
Входные двери
Видео – Установка металлической двери своими руками
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Железодефицитная анемия у детей
Версия: Клинические протоколы МЗ РК — 2018 (Казахстан)
Категории МКБ:
Железодефицитная анемия вторичная вследствие потери крови [хроническая] (D50.0)
Разделы медицины:
Гематология детская, Педиатрия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «25» апреля 2019 года
Протокол №64
Железодефицитная анемия – приобретенное заболевание из группы дефицитных анемий, возникает при дефиците железа, сопровождающееся микроцитарной, гипохромной, норморегенераторной анемией, клиническими проявлениями которой являются сочетание сидеропенического и анемического синдромов.
ВВОДНАЯ ЧАСТЬ
Название протокола: Железодефицитная анемия у детей
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| D50 | Железодефицитная анемия |
| D50.0 | Хроническая постгеморрагическая анемия |
Дата разработки/пересмотра протокола: 2013 год (пересмотр в 2018 г.)
Сокращения, используемые в протоколе:
| АХБ | – | анемия при хронических болезнях |
| ВОЗ | – | Всемирная организация здравоохранения |
| ГПК | – | гидросидполимальтозный комплекс |
| ЖДА | – | железодефицитная анемия |
| ЖКТ | – | желудочно-кишечный тракт |
| ЛДЖ | – | латентный дефицит железа |
| МСНС | – | средняя концентрация гемоглобина в эритроците |
| НТЖ | – | коэффициент насыщения трансферрина железом |
| ОЖСС | – | общая железосвязывающая способность |
| СЖ | — | сывороточное железо |
| СФ | – | сывороточный ферритин |
| ЦП | – | цветовой показатель |
| ЭГДС | – | эзофагогастродуоденоскопия |
| Hb | – | гемоглобин |
| МСН | – | содержание гемоглобина в эритроците |
| MCV | – | средний объем эритроцитов |
| RDW | – | степень анизоциотоза эритроцитов |
Пользователи протокола: врачи общей практики, педиатры, гематологи
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты, которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |
Облачная МИС «МедЭлемент»
Классификация
Классификация:
- I степень (легкая) – уровень Hb 110-90 г/л;
- II степень (средняя) – уровень Hb 90-70 г/л;
- III степень (тяжелая) – уровень Hb менее 70 г/л.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез:
Для анемического синдрома характерны следующие симптомы:
· снижение аппетита;
· шум в ушах;
· мелькание мушек перед глазами;
· плохая переносимость физических нагрузок;
· слабость, вялость, головокружение, раздражительность;
· обмороки;
· одышка;
· снижение работоспособности;
· снижение когнитивных функций;
· снижение качества жизни;
Физикальное обследование
Клинические проявления ЖДА представляют совокупность двух синдромов: сидеропенического и анемического.
Для сидеропенического синдрома характерны следующие симптомы:
· изменения кожи: сухость, появление маленьких пигментных пятен цвета «кофе с молоком», бледность кожи;
· изменения слизистых оболочек: «заеды» в углу рта, глоссит, атрофический гастрит и эзофагит; видимых слизистых оболочек;
· диспептические явления со стороны ЖКТ;
· изменения волос – раздваивание кончика, ломкость и выпадение вплоть до гнездной алопеции;
· изменения ногтей – поперечная исчерченность ногтей больших пальцев рук (в тяжелых случаях и ног), ломкость, расслаивание на пластинки;
· изменение обоняния – пристрастие больного к резким запахам лака, краски ацетона, выхлопных газов автомобиля, концентрированных духов;
· изменения вкуса – пристрастие больного к глине, мелу, сырому мясу, тесту, пельменям и др.;
· боли в икроножных мышцах, изменение тонуса мышц в виде тенденции к гипотонии, гипотония мышц мочевого пузыря с развитием недержания мочи;
· расширение границ сердца, приглушенность сердечных тонов, тахикардия, систолический шум на верхушке сердца.
· Считается, что наличие 4-х симптомов и более из перечисленных выше патогномонично для латентного дефицита железа (ЛДЖ) и ЖДА.
Лабораторные исследования:
Имеется 3 возможности лабораторной диагностики ЖДА:
· ОАК, выполненный «ручным» методом — снижение концентрации Hb (менее 110 г/л), небольшое снижение количества эритроцитов (менее 3,8 х 1012/л), снижение ЦП (менее 0,85), увеличение СОЭ (более 10-12 мм/час), нормальное содержание ретикулоцитов (10-20‰). Дополнительно врач-лаборант описывает анизоцитоз и пойкилоцитоз эритроцитов. ЖДА это микроцитарная, гипохромная, норморегенераторная анемия.
· ОАК, выполненный на автоматическом анализаторе клеток крови — снижаются средний объем эритроцита – MCV (менее 80 фл), среднее содержание Hb в эритроците – MCН (менее 26 пг), средняя концентрация Hb в эритроците – МСНС (менее 320 г/л), повышается степень анизоцитоза эритроцитов – RDW (более 14%).
· Биохимический анализ крови — снижение концентрации сывороточного железа (менее 12,5 мкмоль/л), повышение общей железосвязывающей способности сыворотки (более 69 мкмоль/л), снижение коэффициента насыщения трансферрина железом (менее 17%), снижение сывороточного ферритина (менее 30 нг/мл). В последние годы появилась возможность определения растворимых трансферриновых рецепторов (рТФР), количество которых в условиях дефицита железа увеличивается (более 2,9 мкг/мл).
Инструментальные исследования: нет
Диагностический алгоритм: (схема)
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Мегалобластные анемии | снижается количество эритроцитов и гемоглобина, наблюдаются лейкопения и тромбоцитопения. Кроме того, при обоих типах анемий может развиваться гемолитический синдром | Исследование периферической и венозной крови; миелограмма | При ЖДА не бывает гиперхромной анемии с макроцитозом эритроцитов. Длительность жизни эритроцитов при мегалобластной анемии снижается. Возможное понижение лейкоцитов и тромбоцитов при мегалобластной анемии, когда как при ЖДА данные показатели в норме. Особенности миелограммы (наличие редукции красного кроветворного ростка, а не гиперплазия мегалобластов). |
| Апластическая анемия | Анемический синром, геморрагический синдром на фоне тромбоцитопении, симптомы интоксикации. | Исследование периферической и венозной крови, миелограммы, общего анализа мочи, имунофенотипирова ние периферической крови на ПНГ клон. | При ЖДА в миелограмме не отмечается сокращение всех трех ростков кроветворения, нет жирового перерождение костного мозга. Отрицательный ПНГклон. |
| Талассемия | гипохромная анемия, анизоцитоз эритроцитов, наличие мишеневидных форм эритроцитов (пятно гемоглобина в центре клетки, напоминающее мишень). При этом содержание сывороточного железа нормальное или повышенное. Компенсаторная гиперплазия костного мозга ведёт к нарушениям в строении лицевого черепа. Череп может стать квадратным, башенным; нос приобретает седловидную форму; нарушается прикус и расположение зубов. Отмечается желтушность кожи и слизистых оболочек. Селезёнка и печень увеличены. Больные подвержены инфекционным заболеваниям. Рано начавшаяся анемия обуславливает физическое и умственное недоразвитие ребёнка. | Исследование периферической и венозной крови, миелограммы, генетическое исследование, УЗИ органов брюшной полости, портальной вены, проба Кумбса, определение типов гемоглобина. | Нет генетических мутаций, форма эритроцитов не изменена; сывороточное железо обычно снижено; нет костной деформации; нет желтушного синдрома; отсутствие гепатоспленомегалии; физическое и умственное развитие ребенка соответствуют возрасту. |
| Сидеробластные анемии |
нарушение синтеза гема и митохондриальная дисфункция: неэффективный эритропоэз, высокое содержание железа в крови и гемосидероз внутренних органов. В костном мозге образуются эритроциты малого размера, в которых снижено содержание гемоглобина, а железо откладывается внутри клеток, затем выходит в кровь и оседает в тканях внутренних органов. |
клинический анализ крови; пункция костного мозга, сывороточное железо, УЗИ Органов брюшной полости; генетическое исследование |
При ЖДА снижено сывороточное железо в крови; нет гемохроматоза; отсутствие генетических мутаций |
Лечение
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Немедикаментозное лечение:
- Устранение этиологических факторов;
- Рациональное лечебное питание (для новорожденных – грудное естественное вскармливание, а при отсутствии молока у матери – адаптированные молочные смеси, обогащенные железом. Своевременное введение прикорма, мяса, субпродуктов, гречневой и овсяной круп, фруктовых и овощных пюре, твердых сортов сыра; уменьшение приема фосфатов, танина, кальция, которые ухудшают всасывание железа).
Медикаментозное лечение
В настоящее время в нашей стране используется терапевтический план лечения ЖДА пероральными препаратами железа, суточные дозы которых представлены в таблице.
Возрастные терапевтические дозы пероральных препаратов железа для лечения ЖДА у детей.
| Возраст ребенка | Суточная доза элементарного железа |
| Ионные железосодержащие препараты (солевые, полисахаридные соединения железа) | |
| Дети до 3-х лет | 3 мг/кг |
| Дети старше 3-х лет | 45-60 мг |
| Подростки | до 120 мг |
| Неионные соединения т.е. препараты, представленные гидроксид-полимальтозным комплексом трехвалентного железа | |
| Любой возраст |
5 мг/кг |
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Монокомпонентные препараты железа | |||
| Глюконат железа | Глюконат железа 300 мг | по 1–3 табл. в день | III C |
| Сульфат железа |
Сульфат железа табл. 256.3 мг (80 мг железа), Сульфат железа 325 мг (105 мг иона (II) железа (Fe2+)) |
Детям старше 6 лет до 15 лет назначают по 1 капсуле ежедневно. Подросткам с 15 лет в начале терапии обычно назначают по 1 капсуле 1-2 раза в сутки |
III C |
| Комбинированные препараты | |||
| Железа (II) сульфат сухой + Аскорбиновая кислота 60 мг | Сульфат железа таб.320 мг+аскорбиновая кислота 60 мг | по 1 табл. 1–2 раза в день | III C |
| Препараты железа (III) валентные | |||
| Железа (III) гидроксид полимальтозат |
Железа (III) гидроксид полимальтозат 400 мг (100 мг эл.железа) Таб. 375 мг (100 мг эл.железа) |
По 100 — 300 мг железа (1 — 3 таблетки) ежедневно | IIB |
| Препараты железа для парентерального введения | |||
| Железа оксида сахарат |
Железо III гидроксид сахарозный комплекс 540 мг (железа 20 мг);
|
Ампулы 5,0 развести 0,9% раствором натрия хлорида в соотношении 1:20, например — 1 мл (20 мг железа) в 20 мл 0,9% раствора натрия хлорида. Полученный раствор вводится со следующей скоростью: 100 мг железа — не менее чем за 15 мин; 200 мг железа — в течение 30 мин; 300 мг железа — в течение 1,5 ч; 400 мг железа — в течение 2,5 ч; 500 мг железа — в течение 3,5 ч | II B |
| Железа [III] гидроксид и декстрана комплекс |
Железа III гидроксид-декстрановый комплекс 312,5 мг (50 мг железа) |
Ампулы 2,0 парентеральное введение – в/в капельно разводится в 0,9% растворе натрия хлорида или в 5% растворе глюкозы. Доза 100–200 мг железа (2–4 мл препарата) разводится в 100 мл растворителя. В/в медленно (0,2 мл/мин) в дозе 100–200 мг железа (2–4 мл), предпочтительно разведенного в 10–20 мл 0,9% раствора натрия хлорида или 5% раствора глюкозы. Начальная доза препарата составляет 25 мг железа или 0,5 мл раствора, которая вводится в/в медленно в течение 1–2 мин |
II B |
| Железа оксида полимальтозные комплексы | Железа карбоксимальтозат 156-208 мг (50 мг железа) |
в/в струйно, в максимальной однократной дозе до 4 мл (200 мг железа) в день, но не чаще 3 раз в неделю. в/в (внутривенно) капельно (инфузионно) 1000 мг железа 1 раз в неделю. |
II B |
Дальнейшее ведение:
Диспансерное наблюдение за детьми и подростками с ЖДА проводится в течение 1-го года с момента установления диагноза, контролируются самочувствие и общее состояние больного. Перед снятием больного с диспансерного наблюдения выполняется общий анализ крови, все показатели которого должны быть в пределах нормы.
Медицинской, физической и психологической реабилитации больных после излечения от ЖДА не требуется.
Индикаторы эффективности лечения:
- улучшение аппетита, самочувствия, физической активности, настроения;
- нормализация цвета кожи и видимых слизистых;
- нормализация Hb, ретикулоцитов.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ: см. Амбулаторный уровень
Хирургическое вмешательство: нет
Дальнейшее ведение: см. Амбулаторный уровень
Индикаторы эффективности лечения: см. Амбулаторный уровень
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации: нет
Показания для экстренной госпитализации:
- анемия III степени тяжести;
- необходимость парентерального введения препаратов железа.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2018
- 1) Dado DN, Loesch EB, Jaganathan SP A Case of Severe Iron Deficiency Anemia Associated with Long-Term Proton Pump Inhibitor Use Curr Ther Res Clin Exp. 2017 Jan 21;84:1-3
2) Тарасова И.С. Разработка и научное обоснование скрининга железодефицитных состояний у подростков: Автореф. дис…. д-ра мед. наук. — М.— 67 с.
3) Тарасова И.С., Чернов В.М., Лаврухин Д.Б., Румянцев А.Г. Становление менструальной функции как фактор риска развития анемии // Гематология и трансфузиология. — 2014. — Т. 55, № 4. — С. 3-7.
4) Baker R.D., Greer F.R. Committee on Nutrition American Academy of Pediatrics. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age) // Pediatrics. — 2014. — Vol. 126, N5. — P. 1040-1050.
5) Детская гематология. Клинические рекомендации / Под ред. А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской. Авторы: Айзенберг В.Л., Балашов Д.Н., Биккулова Д.Ш., Вдовин В.В., Володин Н.Н., Демихов В.Г., Демихова Е.В., Евдокимова М.А., Жарков П.А., Журина, О.Н., Зозуля Н.И., Инякова Н.В., Карачунский А.И., Клипинина Н.В., Копылов К.Г., Кузминова Ж.А., Кумирова Э.В., Кумскова М.А., Лазарев В.В., Луговская С.А., Лукина Е.А., Лунякова Е.А., Масчан М.А., Морщакова Е.Ф., Мякова Н.В., Новичкова Г.А., Орлов А.Б., Панкратьева Л.Л., Полевиченко Е.В., Птушкин В.В., Румянцева Ю.В., Самочатова Е.В., Свирин П.В., Сигарева И.А., Скворцова Ю.В., Скобин В.Б., Сметанина Н.С., Спиридонова Е.А., Стефаненко Е.А., Тарасова И.С., Хаин А.Е., Хамин И.Г., Харькин А.В., Хачатрян Л.А., Цветаева Н.В., Цыпин Л.Е., Чернов В.М., Щербина А.Ю., Щукин В.В. — М.: ГЭОТАР-Медиа, 2015. — 656 с.
6) Auerbach M, Deloughery T. Single-dose intravenous iron for iron deficiency: a new paradigm. Hematology Am Soc Hematol Educ Program 2016; 2016:57.
7) Auerbach M, Deloughery T. Single-dose intravenous iron for iron deficiency: a new paradigm. Hematology Am Soc Hematol Educ Program 2016; 2016:57.
Krayenbuehl PA, Battegay E, Breymann C, et al. Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood 2011; 118:3222.
9) Sharma R, Stanek JR, Koch TL, et al. Intravenous iron therapy in non-anemic iron-deficient menstruating adolescent females with fatigue. Am J Hematol 2016; 91:973.
10) Vaucher P, Druais PL, Waldvogel S, Favrat B. Effect of iron supplementation on fatigue in nonanemic menstruating women with low ferritin: a randomized controlled trial. CMAJ 2012; 184:1247.
11) Pittori C, Buser A, Gasser UE, et al. A pilot iron substitution programme in female blood donors with iron deficiency without anaemia. Vox Sang 2011; 100:303.
12) Burden RJ, Morton K, Richards T, et al. Is iron treatment beneficial in, iron-deficient but non-anaemic (IDNA) endurance athletes? A systematic review and meta-analysis. Br J Sports Med 2015; 49:1389.
13) Achebe MM, Gafter-Gvili A. How I treat anemia in pregnancy: iron, cobalamin, and folate. Blood 2017; 129:940.
14) Gomollón F, Gisbert JP. Intravenous iron in inflammatory bowel diseases. Curr Opin Gastroenterol 2013; 29:201.
15) Jimenez K, Gasche C, Auerbach M. On both sides of the ocean. Blood Transfus 2016; 14:197.
16) Lee T, Clavel T, Smirnov K, et al. Oral versus intravenous iron replacement therapy distinctly alters the gut microbiota and metabolome in patients with IBD. Gut 2017; 66:863.
17) García-López S, Bocos JM, Gisbert JP, et al. High-dose intravenous treatment in iron deficiency anaemia in inflammatory bowel disease: early efficacy and impact on quality of life. Blood Transfus 2016; 14:199.
18) Reinisch W, Chowers Y, Danese S, et al. The management of iron deficiency in inflammatory bowel disease—an online tool developed by the RAND/UCLA appropriateness method. Aliment Pharmacol Ther 2013; 38:1109.Gasche C, Evstatiev R, Haas T, et al. [Diagnosis and treatment of iron deficiency and anaemia in inflammatory bowel diseases. Consensus of the Austrian IBD Working Party]. Z Gastroenterol 2011; 49:627.
19) Auerbach M, Adamson JW. How we diagnose and treat iron deficiency anemia. Am J Hematol 2016; 91:31.
20) Kim YW, Bae JM, Park YK, et al. Effect of Intravenous Ferric Carboxymaltose on Hemoglobin Response Among Patients With Acute Isovolemic Anemia Following Gastrectomy: The FAIRY Randomized Clinical Trial. JAMA 2017; 317:2097.
21) Khalafallah AA, Yan C, Al-Badri R, et al. Intravenous ferric carboxymaltose versus standard care in the management of postoperative anaemia: a prospective, open-label, randomised controlled trial. Lancet Haematol 2016; 3:e415.
22) Johansson PI, Rasmussen AS, Thomsen LL. Intravenous iron isomaltoside 1000 (Monofer®) reduces postoperative anaemia in preoperatively non-anaemic patients undergoing elective or subacute coronary artery bypass graft, valve replacement or a combination thereof: a randomized double-blind placebo-controlled clinical trial (the PROTECT trial). Vox Sang 2015; 109:257.
23) Froessler B, Palm P, Weber I, et al. The Important Role for Intravenous Iron in Perioperative Patient Blood Management in Major Abdominal Surgery: A Randomized Controlled Trial. Ann Surg 2016; 264:41.
24) Serrano-Trenas JA, Ugalde PF, Cabello LM, et al. Role of perioperative intravenous iron therapy in elderly hip fracture patients: a single-center randomized controlled trial. Transfusion 2011; 51:97.
- 1) Dado DN, Loesch EB, Jaganathan SP A Case of Severe Iron Deficiency Anemia Associated with Long-Term Proton Pump Inhibitor Use Curr Ther Res Clin Exp. 2017 Jan 21;84:1-3
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
- Омарова Кулян Омаровна – доктор медицинских наук, профессор, гематолог АО «Национальный центр педиатрии и детской хирургии».
- Манжуова Ляззат Нурбапаевна – кандидат медицинских наук, заведующий отделением онкологии №1 АО «Национальный центр педиатрии и детской хирургии».
- Нургалиев Даир Жванышевич – доктор медицинских наук, руководитель отдела онкогематологии и трансплантации гемопоэтических стволовых клеток КФ «UMC» «Национальный научный центр материнства и детства».
- Ашимова Разита Беймбетовна – онкогематолог, отделение онкологии №1 КФ «UMC» Национальный научный центр материнства и детства.
- Ихсанова Алина Кайратовна – онкогематолог, отделение онкологии №1 КФ «UMC» Национальный научный центр материнства и детства.
- Суров Владимир Константинович – клинический фармаколог отдела госпитальной фармации АО «Национальный Центр Нейрохирургии».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
- Абдрахманова Сагира Токсанбаевна. – доктор медицинских наук, профессор кафедры детских болезней НАО «Медицинский университет Астана».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания и патологические состояния, характеризующиеся уменьшением содержания гемоглобина и/или эритроцитов в единице объема крови, приводящие к нарушению снабжения тканей кислородом. Применяются следующие лабораторные критерии анемии (Н. П. Шабалов, 2003). В зависимости от возраста детей уровень гемоглобина составляет:
- 0–1 сутки жизни — < 145 г/л;
- 1–14 дней жизни — < 130 г/л;
- 14–28 дней жизни — < 120 г/л;
- 1 мес — 6 лет — < 110 г/л.
Из всех анемий самой распространенной является железодефицитная (ЖДА), которая составляет примерно 80% от всех анемий. По данным Всемирной организации здравоохранения (ВОЗ), в мире более 500 тыс. человек страдает ЖДА. Распространенность ЖДА у детей в России и развитых европейских странах составляет: около 50% — у детей младшего возраста; более 20% — у детей старшего возраста.
ЖДА — это клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
Железо — один из основных микроэлементов в организме человека. В норме в организме взрослого человека содержится 3–5 г железа в связанной форме. 70% общего количества железа входит в состав гемопротеинов. Железо в этих соединениях связано с порфирином. Основной представитель этой группы — гемоглобин (58% железа); также железо содержится в миоглобине (8%), цитохромах, пероксидазах, каталазах — до 4%. Железо входит и в состав негемовых ферментов (ксантиноксидаза, никотинамидадениндинуклеотид (НАДН)-дегидрогеназа, аконитаза, локализующиеся в митохондриях); транспортной формы железа (трансферрин, лактоферрин). Запасы железа в организме существуют в двух формах: в виде ферритина (до 70%) и гемосидерина (до 30%). Особенность распределения железа у детей младшего возраста заключается в том, что у них выше содержание железа в эритроидных клетках и меньше железа приходится на мышечную ткань.
Всасывание железа происходит преимущественно в двенадцатиперстной кишке и проксимальных отделах тощей кишки. В суточном рационе обычно содержится около 5–20 мг железа, а усваивается только около 1–2 мг в сутки. Степень абсорбции железа зависит как от его количества в потребляемой пище и биодоступности, так и от состояния желудочно-кишечного тракта (ЖКТ).
Легче абсорбируется железо в составе гема (мясные продукты) — 9–22%. Всасывание негемового железа определяется диетой и особенностями желудочно-кишечной секреции.
Особенно активно всасывание железа происходит из грудного молока, хотя его содержание в нем невелико — всего 1,5 мг в литре; биодоступность железа грудного молока составляет до 60%. Этому способствует особая форма, в которой оно представлено, — в виде железосодержащего белка лактоферрина. В молекуле лактоферрина определены два активных центра связывания ионов Fe3+. Лактоферрин в грудном молоке содержится в виде насыщенной и ненасыщенной форм. Соотношение форм лактоферрина меняется в зависимости от периода лактации. В течение первых 1–3 мес жизни превалирует насыщенная железотранспортная форма лактоферрина. Наличие специфических рецепторов к лактоферрину на эпителиальных клетках слизистой оболочки кишечника способствует адгезии с ними лактоферрина и более полной его утилизации. Кроме того, лактоферрин, связывая лишнее, не всосавшееся в кишечнике железо, лишает условно-патогенную микрофлору необходимого для ее жизнедеятельности микроэлемента и запускает неспецифические бактерицидные механизмы. Установлено, что бактерицидная функция иммуноглобулина A реализуется только в присутствии лактоферрина.
Физиологические потери железа с мочой, потом, калом, через кожу, волосы и ногти не зависят от пола и составляют 1–2 мг в сутки, у женщин во время менструации — 2–3 мг в сутки. У детей потеря железа составляет 0,1–0,3 мг в сутки, возрастая до 0,5–1,0 мг в сутки у подростков.
Ежедневная потребность детского организма в железе составляет 0,5–1,2 мг в сутки. У детей раннего возраста в связи с быстрыми темпами роста и развития наблюдается повышенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из депо: у недоношенных детей к 3-му месяцу, у доношенных — к 5–6-му мес жизни. Для обеспечения нормального развития ребенка в суточном рационе новорожденного должно содержаться 1,5 мг железа, а у ребенка 1–3 лет — не менее 10 мг.
Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и ЖКТ. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка. Установлено, что у детей, имевших в младенчестве железодефицитную анемию, в возрасте 3–4 лет определяются нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения из-за нарушения миелинизации и, как следствие этого, нарушение проводимости нервов.
Причины железодефицитных состояний у детей очень разнообразны. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. К антенатальным причинам относят также и осложненное течение беременности, нарушение маточно-плацентарного кровообращения, фетоматеринские и фетоплацентарные кровотечения, синдром фетальной трансфузии при многоплодной беременности. Интранатальными причинами дефицита железа являются: фетоплацентарная трансфузия, преждевременная или поздняя перевязка пуповины, интранатальные кровотечения из-за травматических акушерских пособий или аномалий развития плаценты или пуповины. Среди постнатальных причин сидеропенических состояний на первое место выступает недостаточное поступление железа с пищей. При этом более всего страдают новорожденные, находящиеся на искусственном вскармливании неадаптированными молочными смесями, коровьим и козьим молоком. Другими постнатальными причинами ЖДА являются: повышенная потребность организма в железе; потери железа, превышающие физиологические; заболевания ЖКТ, синдром нарушенного кишечного всасывания; дефицит запасов железа при рождении; анатомические врожденные аномалии (дивертикул Меккеля, полипозы кишечника); употребление продуктов, тормозящих абсорбцию железа.
В группе риска всегда находятся недоношенные дети и дети, родившиеся с очень большой массой, дети с лимфатико-гипопластическим типом конституции.
У детей первого года жизни к дефициту железа чаще всего приводит несбалансированная диета, в частности вскармливание исключительно молоком, вегетарианство, недостаточное употребление мясных продуктов.
К сидеропении способны приводить кровотечения различной этиологии. Источником этого могут быть: грыжа пищеводного отверстия диафрагмы, варикозное расширение вен пищевода, желудочно-кишечные язвы, опухоли, дивертикулы, язвенный колит, геморроидальные узлы, а также кровотечения из мочеполового тракта и дыхательных путей. Прием некоторых медикаментов, таких как нестероидные противовоспалительные препараты, салицилаты, кумарины, глюкокортикостероиды, также может привести к потере железа. Дефицит железа всегда сопутствует заболеваниям, сопровождающимся нарушениями кишечного всасывания (энтериты, болезнь Крона, паразитарные инвазии и др.). Дисбактериоз кишечника также препятствует нормальному перевариванию пищи и тем самым снижает способность организма усваивать железо. Кроме того, может иметь место нарушение транспорта железа из-за недостаточной активности и снижения содержания трансферрина в организме.
Распознать причину развития ЖДА в каждом конкретном случае чрезвычайно важно. Ориентация на нозологическую диагностику необходима, так как в большинстве случаев при лечении анемии можно воздействовать и на основной патологический процесс.
ЖДА проявляется общими симптомами. Один из главных и видимых признаков — бледность кожных покровов, слизистых оболочек, конъюнктив глаз. Обращают на себя внимание общая вялость, капризность, плаксивость, легкая возбудимость детей, снижение общего тонуса организма, потливость, отсутствие или снижение аппетита, поверхностный сон, срыгивание, рвота после кормления, понижение остроты зрения. Выявляются изменения со стороны мышечной системы: ребенок с трудом преодолевает физические нагрузки, отмечается слабость, утомляемость. У детей первого года жизни может наблюдаться регресс моторных навыков.
Во втором полугодии жизни и у детей старше года наблюдаются признаки поражения эпителиальной ткани — шершавость, сухость кожи, ангулярный стоматит, болезненные трещины в уголках рта, глоссит или атрофия слизистой оболочки ротовой полости, ломкость и тусклость волос, их выпадение, матовость и ломкость ногтей, разрушение зубов (кариес), отставание в физическом и психомоторном развитии.
В зависимости от степени тяжести заболевания выявляются симптомы поражения органов и систем: сердечно-сосудистой — в виде функционального шума в сердце, тахикардии; нервной системы — в виде головных болей, головокружений, обмороков, ортостатических коллапсов. Возможно увеличение размеров печени, селезенки. Со стороны ЖКТ наблюдается затрудненное глотание, вздутие кишечника, диарея, запоры, извращение вкуса — желание есть глину, землю.
Диагноз ЖДА ставится на основании клинической картины, лабораторных признаков анемии и дефицита железа в организме: гипохромная (цветовой показатель < 0,85) анемия различной степени тяжести, гипохромия эритроцитов, снижение средней концентрации гемоглобина в эритроците (менее 24 пг), микроцитоз и пойкилоцитоз эритроцитов (в мазке периферической крови); уменьшение количества сидеробластов в пунктате костного мозга; уменьшение содержания железа в сыворотке крови (< 12,5 мкмоль/л); повышение общей железосвязывающей способности сыворотки (ОЖСС) более 85 мкмоль/л (показатель «голодания»); повышение уровня трансферрина в сыворотке крови, при снижении его насыщения железом (менее 15%); снижение уровня ферритина в сыворотке (< 15 мкг/л).
Лечение ЖДА
Лечение ЖДА у детей раннего возраста должно быть комплексным и базироваться на четырех принципах: нормализация режима и питания ребенка; возможная коррекция причины железодефицита; назначение препаратов железа; сопутствующая терапия.
Важнейшим фактором коррекции железодефицита является сбалансированное питание, и в первую очередь грудное вскармливание. Грудное молоко не только содержит железо в высокобиодоступной форме, но и повышает абсорбцию железа из других продуктов, употребляемых одновременно с ним. Однако интенсивные обменные процессы у грудных детей приводят к тому, что к 5–6-му мес жизни антенатальные запасы железа истощаются даже у детей с благополучным перинатальным анамнезом и малышей, вскармливаемых грудным молоком.
Из других продуктов питания наибольшее количество железа содержится в свиной печени, говяжьем языке, телячьих почках, яичном желтке, устрицах, бобах, кунжуте, морской капусте, пшеничных отрубях, гречке, фисташках, турецком горохе, персиках, овсяных хлопьях, шпинате, лесных орехах и др. (табл.).
Абсорбцию железа тормозят танины, содержащиеся в чае, карбонаты, оксалаты, фосфаты, этилендиаминтетрауксусная кислота, используемая в качестве консерванта, антацидные препараты, тетрациклины. Аскорбиновая, лимонная, янтарная и яблочная кислоты, фруктоза, цистеин, сорбит, никотинамид усиливают всасывание железа.
Необходимы длительные прогулки на свежем воздухе, нормализация сна, благоприятный психологический климат, профилактика острых респираторных вирусных инфекций (ОРВИ), ограничение физической нагрузки. Питание ребенка должно быть сбалансированным и включать продукты, богатые железом, и вещества, усиливающие его всасывание в кишечнике. Детям, страдающим ЖДА, необходимо вводить прикорм на 2–4 нед раньше, чем здоровым. Введение мясного прикорма целесообразно начинать в 6 мес. Следует отказаться от введения в рацион ребенка таких каш, как манная, рисовая, толокняная, отдавая предпочтение гречневой, ячменной, просяной.
Однако эти меры недостаточны и не приводят к излечению ЖДА, поэтому основой терапии являются препараты железа. К основным из них, применяемым перорально, относятся: соединения трехвалентного железа — гидроксид-полимальтозный комплекс (полимальтозат железа), мальтофер, мальтофер фол, феррум лек и железо-протеиновый комплекс (железа протеин сукцинилат) — ферлатум; соединения двухвалентного железа — актиферрин, ферроплекс, тардиферон, гемофер, тотема, фумарат железа, ферронат.
Начинать терапию следует препаратами для приема внутрь и только при плохой их переносимости (тошнота, рвота, диарея), синдроме нарушенного всасывания, резекции тонкого кишечника и т. д. — препараты железа назначают парентерально. При назначении пероральных форм следует отдавать предпочтение неионным соединениям железа — протеиновый (ферлатум) и гидроксид-полимальтозный комплексы Fe3+ (мальтофер, мальтофер фол, феррум лек). Эти соединения имеют большую молекулярную массу, что затрудняет их диффузию через мембрану слизистой кишечника. Они поступают из кишечника в кровь в результате активного всасывания. Это объясняет невозможность передозировки препаратов в отличие от солевых соединений железа, всасывание которых происходит по градиенту концентрации. Взаимодействия их с компонентами пищи и лекарственными препаратами не происходит, что позволяет использовать неионные соединения железа, не нарушая режим питания и терапии сопутствующей патологии. Их применение существенно снижает частоту развития побочных эффектов, обычно наблюдаемых при назначении пероральных препаратов железа (тошнота, рвота, диарея, запоры и др.). Кроме того, у детей раннего возраста большое значение имеет лекарственная форма препарата. В этом возрасте удобно использовать капли и сиропы, что обеспечивает в том числе возможность точного дозирования препаратов и не вызывает негативного отношения ребенка.
При назначении любых препаратов железа необходимо рассчитывать индивидуальную потребность в нем для каждого пациента, исходя из того, что оптимальная суточная доза элементарного железа составляет 4–6 мг/кг. Среднесуточная доза железа при лечении ЖДА составляет 5 мг/кг. Применение более высоких доз не имеет смысла, поскольку объем всасывания железа не увеличивается.
Применение парентеральных препаратов железа показано для быстрого достижения эффекта при анемии тяжелой степени; патологии ЖКТ, сочетающейся с нарушением всасывания; неспецифическом язвенном колите; хроническом энтероколите; при тяжелой непереносимости оральных форм препаратов. На сегодняшний день в Российской Федерации для внутривенного введения разрешен только один препарат — венофер (сахарат железа), для внутримышечного может использоваться феррум лек.
Необходимо помнить, что у детей раннего возраста дефицит железа никогда не бывает изолированным и часто сочетается с недостаточностью витаминов С, В12, В6, РР, А, Е, фолиевой кислоты, цинка, меди и др. Это связано с тем, что алиментарная недостаточность и нарушенное кишечное всасывание, приводящие к дефициту железа, влияют и на насыщаемость данными микронутриентами. Поэтому в комплексную терапию ЖДА необходимо включать поливитаминные препараты.
Об эффективности терапии ЖДА можно судить уже через 7–10 дней по увеличению ретикулоцитов в 2 раза по сравнению с исходным количеством (так называемый ретикулоцитарный криз). Также оценивается прирост гемоглобина, который должен составлять 10 г/л и более в неделю. Соответственно, достижение целевого уровня гемоглобина наблюдается в среднем через 3–5 нед от начала терапии в зависимости от тяжести анемии. Однако лечение препаратами железа должно проводиться в достаточных дозах и длительно (не менее 3 мес) даже после нормализации уровня гемоглобина, с тем чтобы пополнить запасы железа в депо.
Если же в течение 3–4 нед не наблюдается значимого улучшения показателей гемоглобина, то необходимо выяснить, почему лечение оказалось неэффективным. Наиболее часто речь идет: о неадекватной дозе препарата железа; продолжающейся или неустановленной кровопотере; наличии хронических воспалительных заболеваний или новообразований; сопутствующем дефиците витамина В12; неверном диагнозе; глистной инвазии и других паразитарных инфекциях.
Противопоказаниями к назначению препаратов железа являются:
- отсутствие лабораторного подтверждения дефицита железа;
- сидероахрестические анемии;
- гемолитические анемии;
- гемосидероз и гемохроматоз;
- инфекция, вызванная грамотрицательной флорой (энтеробактерии, синегнойная палочка, клебсиелла).
При развитии тяжелых анемий, сопровождаемых угнетением эритропоэза и снижением продукции эритропоэтина, показано назначение препаратов рекомбинантного человеческого эритропоэтина (рчЭПО). Особое значение имеет применение рчЭПО при развитии ранней анемии недоношенных, которая развивается на втором месяце жизни и встречается, по данным различных авторов, в 20–90% случаев. Назначение препаратов рчЭПО (рекормон, эпрекс, эпокрин) приводит к резкой активизации эритропоэза и, как следствие, к значительному возрастанию потребностей в железе.
Поэтому применение рчЭПО является показанием к назначению препаратов железа, как правило, парентеральных. В настоящее время в Российской Федерации разрешены к применению a- и b-эпоэтины, которые вошли в список дополнительного лекарственного обеспечения. Назначeние рчЭПО позволяет в большинстве случаев избежать гемотрансфузий, при которых велика вероятность осложнений (трансфузионные реакции, сенсибилизация и пр.). Предпочтительным способом введения препаратов рчЭПО, особенно в раннем детском возрасте, является подкожный. Подкожный способ введения более безопасный и экономичный, так как для достижения эффекта необходимы меньшие дозы, чем при внутривенном введении. До недавнего времени в странах Евросоюза и в Российской Федерации для лечения гипорегенераторных анемий у детей использовались в основном β-эритропоэтины, которые при подкожном введении не вызывали значимых побочных реакций в отличие от a-эритропоэтинов, при подкожном введении которых был велик риск развития красноклеточной аплазии. Наиболее широкое распространение среди β-эритропоэтинов получил препарат рекормон (Ф. Хоффманн-Ля Рош), который удобен в применении и приводит к быстрому повышению уровня эритроцитов и ретикулоцитов, не влияя на лейкопоэз, повышает уровень гемоглобина, а также скорость включения железа в клетки.
С 2004 г. в европейских странах разрешено подкожное введение a-эритропоэтинов, среди которых в нашей стране наиболее часто используются эпрекс (Янсен-Силаг) и эпокрин (Сотекс-ГосНИИ ОЧБ).
Целью лечения рчЭПО является достижение показателей гематокрита 30–35% и устранение необходимости переливаний крови. Значения целевой концентрации гемоглобина могут варьировать в зависимости от дней и месяцев жизни ребенка, однако не могут быть ниже 100–110 г/л. В зависимости от дозы целевые значения концентрации гемоглобина и гематокрита достигаются примерно через 8–16 нед лечения рчЭПО.
С целью профилактики ЖДА рчЭПО назначается недоношенным новорожденным, родившимся с массой тела 750–1500 г до 34-й недели беременности.
Лечение эритропоэтином должно начинаться как можно раньше и продолжаться 6 нед. Препарат рекормон вводят подкожно в дозе 250 МЕ/кг 3 раза в неделю. Однако необходимо учитывать, что чем меньше возраст ребенка, тем более высокие дозы эритропоэтина ему требуются, поэтому доза может быть увеличена.
Как было сказано выше, терапия рчЭПО приводит к резкому возрастанию потребления железа, поэтому в большинстве случаев, особенно у недоношенных детей, одновременно с повышением гематокрита снижается содержание ферритина в сыворотке. Быстрое расходование запасов железа в организме может привести к ЖДА. Поэтому всем больным, получающим терапию рчЭПО, показано назначение препаратов железа. Терапия препаратами железа должна продолжаться до нормализации уровня сывороточного ферритина (не менее 100 мкг/мл) и насыщения трансферрина (не менее 20%). Если концентрация ферритина в сыворотке сохраняется стойко ниже 100 мкг/мл или есть другие признаки дефицита железа, дозу железа следует увеличить, в том числе с использованием парентеральных препаратов.
Профилактика ЖДА у детей раннего возраста включает в себя: антенатальную (правильный режим и питание беременной, своевременное выявление и лечение анемии беременной, превентивное назначение препаратов железа женщинам из групп риска по развитию ЖДА); постнатальную (соблюдение гигиенических условий жизни ребенка, длительное грудное вскармливание и своевременное введение прикормов, адекватный выбор смеси для детей, находящихся на смешанном и искусственном вскармливании, профилактика развития у ребенка рахита, гипотрофии и ОРВИ). В профилактическом назначении препаратов железа нуждаются:
- женщины репродуктивного возраста, страдающие обильными и длительными менструальными кровотечениями;
- постоянные доноры;
- беременные, особенно повторные беременности, следующие с коротким интервалом;
- женщины с дефицитом железа в период лактации.
Профилактическое назначение препаратов железа показано детям из групп риска по развитию ЖДА:
- недоношенные дети (с 2-месячного возраста);
- дети от многоплодной беременности, осложненных беременностей и родов;
- крупные дети с высокими темпами прибавки массы и роста;
- дети с аномалиями конституции;
- страдающие атопическими заболеваниями;
- находящиеся на искусственном вскармливании неадаптированными смесями;
- с хроническими заболеваниями;
- после кровопотерь и хирургических вмешательств;
- с синдромом мальабсорбции.
Доза железа, назначаемого с профилактической целью, зависит от степени недоношенности ребенка:
- для детей с массой тела при рождении менее 1000 г — 4 мг Fe /кг/день;
- для детей с массой тела при рождении от 1000 до 1500 г — 3 мг Fe/кг/день;
- для детей с массой тела при рождении от 1500 до 3000 г — 2 мг Fe/кг/день.
Значимость проблемы ЖДА у детей раннего возраста обусловлена ее большой распространенностью в популяции и частым развитием при различных заболеваниях, что требует постоянной настороженности врачей любых специальностей. Тем не менее на современном этапе в арсенале врача имеется достаточно диагностических и лечебных возможностей для раннего выявления и своевременной коррекции сидеропенических состояний.
Литература
- Анемии у детей/под ред. В. И. Калиничевой. Л.: Медицина, 1983. 360 с.
- Анемии у детей: диагностика и лечение/под ред. А. Г. Румянцева, Ю. Н. Токарева. М., 2000. 128 с.
- Аркадьева Г. В. Диагностика и лечение железодефицитных анемий. М., 1999. 59 с.
- Белошевский В. А. Железодефицит у взрослых, детей и беременных. Воронеж, 2000. 121 с.
- Борисова И. П., Скобин В. Б., Павлов А. Д. Раннее назначение рекомбинантного эритропоэтина у недоношенных детей/7-й Национальный конгресс «Человек и лекарство». М., 2000. С. 125.
- Вахрамеева С. Н., Денисова С. Н. Латентная форма железодефицитной анемии беременных женщин и состояние здоровья их детей//Российский вестник перинатологии и педиатрии. 1996. № 3. С. 26–29.
- Дворецкий Л. И., Воробьев П. А. Дифференциальный диагноз и лечение при анемическом синдроме. М.: Ньюдиамед, 1994. 24 с.
- Дворецкий Л. И. Железодефицитные анемии//Русский медицинский журнал. 1997. № 19. С. 1234–1242.
- Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 190 с.
- Казакова Л. М., Макрушин И. М. Иммунитет при дефиците железа// Педиатрия. 1992. № 10–12. С. 54–59.
- Казюкова Т. В., Самсыгина Г. А., Левина А. А. Дефицит железа у детей: проблемы и решения//Consilium medicum. 2002. С. 17–19.
- Малаховский Ю. Е., Манеров Ф. К., Сарычева Е. Г. Легкая форма железодефицитной анемии и латентный дефицит железа — пограничные состояния у детей первых двух лет жизни//Педиатрия. 1988. № 3. С. 27–34.
- Папаян А. В., Жукова Л. Ю. Анемии у детей: руководство для врачей. СПб.: Питер, 2001. 382 с.
- Пригожина Т. А. Эффективность рекомбинантного эритропоэтина в комплексной профилактике и лечении ранней анемии недоношенных: автореф. дис. … канд. мед. наук. М., 2001. 19 с.
- Румянцев А. Г., Морщакова Е. Ф. Павлов А. Д. Эритропоэтин. Биологические свойства. Возрастная регуляция эритропоэза. Клиническое применение. М., 2002. С. 137–144; 266–270.
- Румянцев А. Г., Морщакова Е. Ф., Павлов А. Д. Эритропоэтин в диагностике, профилактике и лечении анемий. М., 2003. 568 с.
- Сергеева А. И., Султанова К. Ф., Левина А. А. и др. Показатели метаболизма железа у беременных женщин и детей раннего возраста//Гематология и трансфузиология. 1993. № 9–10. С. 30–33.
- Тетюхина Л. Н., Казакова Л. М. Профилактика дефицита железа как мера по снижению заболеваемости детей//Педиатрия. 1987. № 4. С. 72–73.
- Dallman P. R., Looker A. C., Johnson C. L. et al. Iron Nutrition in Health and Disease. Eds. Hallberg L., Asp N. G. Libbey; London. 1996; 65–74.
- Messer Y., Escande B. Erytropoietin and iron in the anemia of prematurity. TATM 1999; 15–17.
- Ohls R. K. The use of erythropoetin in neonatoles//Clin Perinatol. 2000; 20 (3): 681–696.
- Ulman J. The role of erythropoietin in erythropoiesis regulation in fetuses and newborn infants//Ginekol. Pol. 1996; 67:205–209.
Л. А. Анастасевич, кандидат медицинских наук
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва
Мальтофер сироп — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
П N011981/04
Торговое название:
Мальтофер® (Maltofer®)
Международное непатентованное название или группировочное название:
железа(III) гидроксид полимальтозат
Химическое название:
железа(III) гидроксид полимальтозат
Лекарственная форма:
сироп
Состав:
1 мл препарата содержит:
| активное вещество: | |
| железа(III) гидроксид полимальтозат | 35,7 мг |
| в пересчете на железо | 10,0 мг |
| вспомогательные вещества: | |
| сахароза | 200,0 мг |
| раствор сорбитола 70% | 400,0 мг |
| метилпарагидроксибензоат | 0,583 мг |
| пропилпарагидроксибензоат | 0,167 мг |
| этанол 96% | 3,25 мг |
| ароматизатор кремовый | 3,0 мг |
| натрия гидроксид | до рН 5,0-7,0 |
| вода очищенная | до 1 мл |
Описание
Раствор темно-коричневого цвета.
Фармакотерапевтическая группа:
железа препарат.
Код АТХ:
B03AB05
Фармакологические свойства
Фармакодинамика
В железа(III) гидроксид полимальтозате многоядерный гидроксид железа(III) снаружи окружен множеством ковалентно связанных молекул полимальтозата, что даёт общую среднюю молекулярную массу приблизительно 50 кДа. Структура многоядерного ядра железа(III) гидроксид полимальтозата сходна со структурой ядра белка ферритина – физиологического депо железа. Железа(III) гидроксид полимальтозат стабилен и в физиологических условиях не выделяет большого количества ионов железа. Из-за размера степень диффузии железа(III) гидроксид полимальтозата через слизистую оболочку приблизительно в 40 раз меньше по сравнению с комплексом шестиводного железа(II).
Железо из железа(III) гидроксид полимальтозата активно всасывается в кишечнике.
Эффективность препарата Мальтофер® для нормализации содержания гемоглобина и восполнения депо железа была продемонстрирована в многочисленных рандомизированных контролируемых клинических исследованиях с использованием плацебо-контроля или активного препарата сравнения, проведенных у взрослых и детей с различным статусом депо железа.
Фармакокинетика
Всасывание
Железо из железа(III) гидроксид полимальтозата всасывается в соответствии с контролируемым механизмом. Повышение содержания сывороточного железа после применения препарата не коррелирует с общим всасыванием железа, измеренным как встраивание в гемоглобин (Hb). Исследования с меченым радиоизотопом железа(III) гидроксид полимальтозатом выявили сильную корреляцию между включением железа в эритроциты и содержанием железа во всем организме. Максимальная активность всасывания железа из железа(III) гидроксид полимальтозата отмечается в двенадцатиперстной и тонкой кишке. Как и в случае с другими пероральными препаратами железа, относительное всасывание железа из железа(III) гидроксид полимальтозата, определенное как встраивание в гемоглобин, снижается с повышением доз железа. Кроме того, наблюдалась корреляция между степенью выраженности дефицита железа (в частности, концентрацией ферритина в сыворотке крови) и относительным количеством всосавшегося железа (то есть, чем больше выражен дефицит железа, тем лучше относительное всасывание). У пациентов с анемией всасывание железа из железа(III) гидроксид полимальтозата в отличие от солей железа увеличивалось в присутствии пищи.
Распределение
Распределение железа из железа(III) гидроксид полимальтозата после всасывания было изучено в исследовании с использованием техники двойных изотопов (55Fe и 59Fe).
Биотрансформация
Всосавшееся железо связывается с трансферрином и используется для синтеза гемоглобина в костном мозге или хранится, главным образом в печени, где связывается с ферритином.
Выведение
Невсосавшееся железо выводится кишечником (с калом).
Показания к применению
- Лечение дефицита железа без анемии (латентного дефицита железа) и лечение клинически выраженной железодефицитной анемии (см. раздел «Способ применения и дозы»).
- Повышенная потребность в железе во время беременности и в период грудного вскармливания, донорства крови, интенсивного роста, вегетарианства и пожилого возраста.
Противопоказания
- Установленная гиперчувствительность к железа(III) гидроксид полимальтозату или к любому вспомогательному веществу.
- Перегрузка железом (например, гемосидероз, гемохроматоз).
- Нарушение утилизации железа (например, свинцовая анемия, сидероахрестическая анемия, талассемия).
- Анемия, не связанная с дефицитом железа (например, гемолитическая анемия или мегалобластная анемия, вызванная недостатком витамина B12).
- Дефицит сахаразы/изомальтазы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция.
С осторожностью
Содержит этанол, поэтому препарат назначают с осторожностью пациентам с заболеваниями печени, алкоголизмом, при черепно-мозговой травме или с заболеваниями головного мозга.
Применение во время беременности и в период грудного вскармливания
Беременность
До настоящего времени не поступало сообщений о серьезных нежелательных реакциях после приёма препарата Мальтофер® внутрь в терапевтических дозах при лечении анемии во время беременности. Данные, полученные при исследованиях на животных, не показали опасности для плода и матери. Данные клинических исследований о применении препарата Мальтофер® в I триместре беременности отсутствуют.
В исследованиях, проведенных у беременных женщин после окончания I триместра беременности, не обнаружено никаких нежелательных эффектов препарата Мальтофер® в отношении матерей и/или новорожденных. В связи с этим неблагоприятное влияние на плод при применении препарата Мальтофер® маловероятно.
Период грудного вскармливания
Грудное молоко женщины содержит железо, связанное с лактоферрином. Количество железа, переходящего из железа(III) гидроксид полимальтозата в грудное молоко, неизвестно. Маловероятно, что применение препарата Мальтофер® женщинами, кормящими грудью, способно привести к нежелательным эффектам у ребенка.
В качестве меры предосторожности женщинам детородного возраста и женщинам в период беременности и грудного вскармливания следует принимать препарат Мальтофер® только после консультации с врачом. Рекомендуется проводить оценку соотношения пользы и риска.
Способ применения и дозы
Для приема внутрь.
Суточную дозу можно разделить на несколько приемов или принимать за один раз. Мальтофер® следует принимать во время или сразу же после приема пищи.
Точную дозу препарата можно отмерить с помощью мерного колпачка, прилагаемого к препарату Мальтофер®, сироп 10 мг/мл.
Мальтофер® можно смешивать с фруктовыми и овощными соками, или с детской пищей, или неалкогольными напитками. Лёгкое окрашивание смеси не оказывает влияния ни на её вкус, ни на эффективность препарата.
Суточная доза препарата зависит от степени дефицита железа (см. таблицу суточных доз).
Таблица суточных доз для детей и взрослых в соответствии с возрастом
| Категория пациентов | Лечение железодефицитной анемии | Лечение дефицита железа без анемии | Повышенная потребность в железе |
| Дети до 1 года | 2,5-5 мл (25-50 мг железа) |
–* (15-25 мг железа) |
– * |
| Дети от 1 до 12 лет | 5-10 мл (50-100 мг железа) |
2,5-5 мл (25-50 мг железа) |
– * |
| Дети старше 12 лет | 10-30 мл (100-300 мг железа) |
5-10 мл (50-100 мг железа) |
– * |
| Взрослые и женщины, кормящие грудью | 10-30 мл (100-300 мг железа) |
5-10 мл (50-100 мг железа) |
5-10 мл (50-100 мг железа) |
| Беременные женщины | 20-30 мл (200-300 мг железа) |
10 мл (100 мг железа) |
10 мл (100 мг железа) |
* В связи с необходимостью назначения очень малых доз по этим показаниям рекомендуется использовать препарат Мальтофер®, капли для приема внутрь 50 мг/мл.
Лечение железодефицитной анемии у детей и взрослых
Лечение до достижения нормального содержания гемоглобина (Hb) занимает приблизительно от 3 до 5 месяцев. После этого лечение следует продолжить в течение 1-2 месяцев в дозе, описанной для случая дефицита железа без анемии, с целью восполнения запасов железа.
Лечение железодефицитной анемии во время беременности
Лечение следует продолжать до нормализации содержания гемоглобина (Hb). После этого лечение следует продолжить как минимум до конца беременности в дозе, описанной для случая дефицита железа без анемии, с целью восполнения запасов железа и удовлетворения возросших в связи с беременностью потребностей в железе.
Лечение и предупреждение дефицита железа без анемии
Лечение занимает приблизительно от 1 до 2 месяцев.
Побочное действие
Безопасность и переносимость препарата Мальтофер® оценена во множестве клинических исследований. Основные нежелательные лекарственные реакции (НЛР), отмеченные в данных исследованиях, имели место в следующих трёх классах систем и органов.
Нежелательные лекарственные реакции, наблюдавшиеся в клинических исследованиях
| Классы и системы органов | Очень частые (≥1/10) |
Частые (≥1/100, <1/10) |
Нечастые (≥1/1000, <1/100) |
| Нарушения со стороны нервной системы | – | – | Головная боль |
| Нарушения со стороны желудочно-кишечного тракта | Изменение цвета кала1 | Диарея, тошнота, диспепсия | Рвота, запор, боль в животе, изменение цвета эмали зубов2 |
| Нарушения со стороны кожи и подкожных тканей | – | – | Сыпь3, зуд |
1. Часто регистрировали как нежелательное явление (у 23% пациентов), это хорошо известная НЛР на пероральные препараты железа.
2. Регистрировали как нежелательное явление у 0,6% пациентов, и это хорошо известная НЛР на пероральные препараты железа.
3. Включая экзантему.
Спонтанные постмаркетинговые сообщения о нежелательных лекарственных реакциях
Не отмечено дополнительных нежелательных лекарственных реакций.
Отклонения лабораторных показателей
Данные отсутствуют.
Передозировка
В случае передозировки препаратом Мальтофер® перегрузка железом или интоксикация маловероятны, что связано с низкой токсичностью железа(III) гидроксид полимальтозата и контролируемым захватом железа. О случаях непреднамеренного отравления с летальным исходом не сообщалось.
Взаимодействие с другими лекарственными средствами
Были изучены взаимодействия железа(III) гидроксид полимальтозата с тетрациклином или гидроксидом алюминия. Существенного снижения всасывания тетрациклина не наблюдалось. Концентрация тетрациклина в плазме крови не опускалась ниже эффективного уровня. Всасывание железа из железа(III) гидроксид полимальтозата не снижалось под влиянием алюминия гидроксида или тетрациклина. Таким образом, железа(III) гидроксид полимальтозат можно применять одновременно с тетрациклином и другими фенольными соединениями, а также с гидроксидом алюминия.
В исследованиях у крыс с использованием тетрациклина, гидроксида алюминия, ацетилсалициловой кислоты, сульфасалазина, кальция карбоната, кальция ацетата и кальция фосфата в комбинации с витамином D3, бромазепама, магния аспартата, D-пеницилламина, метилдопы, парацетамола и ауранофина не было обнаружено взаимодействий с железа(III) гидроксид полимальтозатом.
Также не отмечено взаимодействия железа(III) гидроксид полимальтозата с компонентами продуктов питания, такими, как фитиновая кислота, щавелевая кислота, танин, натрия альгинат, холин и холиновые соли, витамин А, витамин D3 и витамин Е, соевое масло и соевая мука. Данные результаты свидетельствуют о том, что железа(III) гидроксид полимальтозат можно принимать во время или сразу же после приёма пищи.
Приём препарата не оказывает влияния на результаты определения скрытой крови (с селективным определением гемоглобина), поэтому прерывать лечение не нужно.
Необходимо избегать одновременного применения парентеральных и пероральных препаратов железа, поскольку всасывание железа, принимаемого внутрь, замедляется.
Особые указания
Суточная доза препарата содержит этанол в количестве от 0,008 г (доза 2,5 мл) до 0,1 г (доза 30 мл). При назначении препарата пациентам с сахарным диабетом следует учитывать, что 1 мл сиропа содержит 0,04 хлебных единиц.
Анемия может быть вызвана инфекционными заболеваниями или злокачественными новообразованиями. Поскольку железо можно принимать лишь после устранения основной причины заболевания, следует определить соотношение пользы и риска лечения.
Во время лечения препаратом Мальтофер® может отмечаться тёмное окрашивание кала, однако это не имеет клинического значения.
Мальтофер® содержит сахарозу, которая может нанести вред зубам.
Вспомогательные вещества натрия метилпарагидроксибензоат и натрия пропилпарагидроксибензоат могут вызывать аллергические реакции (возможно, замедленного типа).
Влияние на способность управлять транспортными средствами, механизмами
Данные отсутствуют. Маловероятно, что препарат Мальтофер® оказывает влияние на способность управлять транспортными средствами, механизмами.
Форма выпуска
Сироп 10 мг/мл.
По 75 мл или 150 мл во флаконы темного стекла, закрытые навинчиваемыми крышками из полиэтилена высокого давления с контролем первого вскрытия и мерным колпачком, надетым на крышку.
По 1 флакону с инструкцией по применению помещают в картонную пачку.
Условия хранения
В защищенном от света месте при температуре не выше 25°C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение / Компания, осуществляющая выпускающий контроль качества
Вифор (Интернэшнл) Инк.
Рехенштрассе 37, СН-9014 Ст. Галлен, Швейцария
Vifor (International) Inc.
Rechenstrasse 37, CH-9014 St. Gallen, Switzerland
Производитель
Вифор С.А.
Рут де Монкор 10, СН-1752 Виллар-сюр-Глан, Швейцария
Vifor S.A.
Route de Moncor 10, CH-1752 Villars-sur-Glâne, Switzerland
Организация, принимающая претензии потребителей
ООО «Такеда Фармасьютикалс»
119048, г. Москва, ул. Усачева, д. 2, стр. 1
Купить Мальтофер сироп в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)


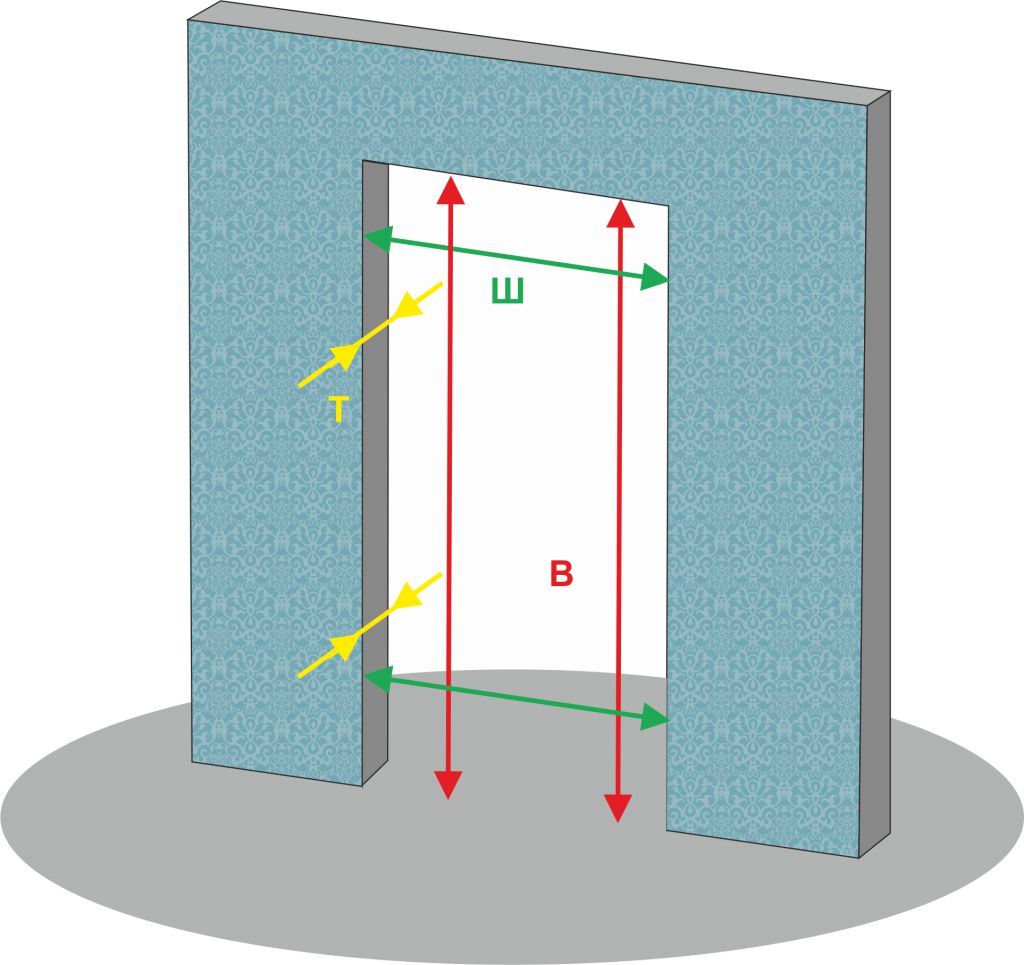
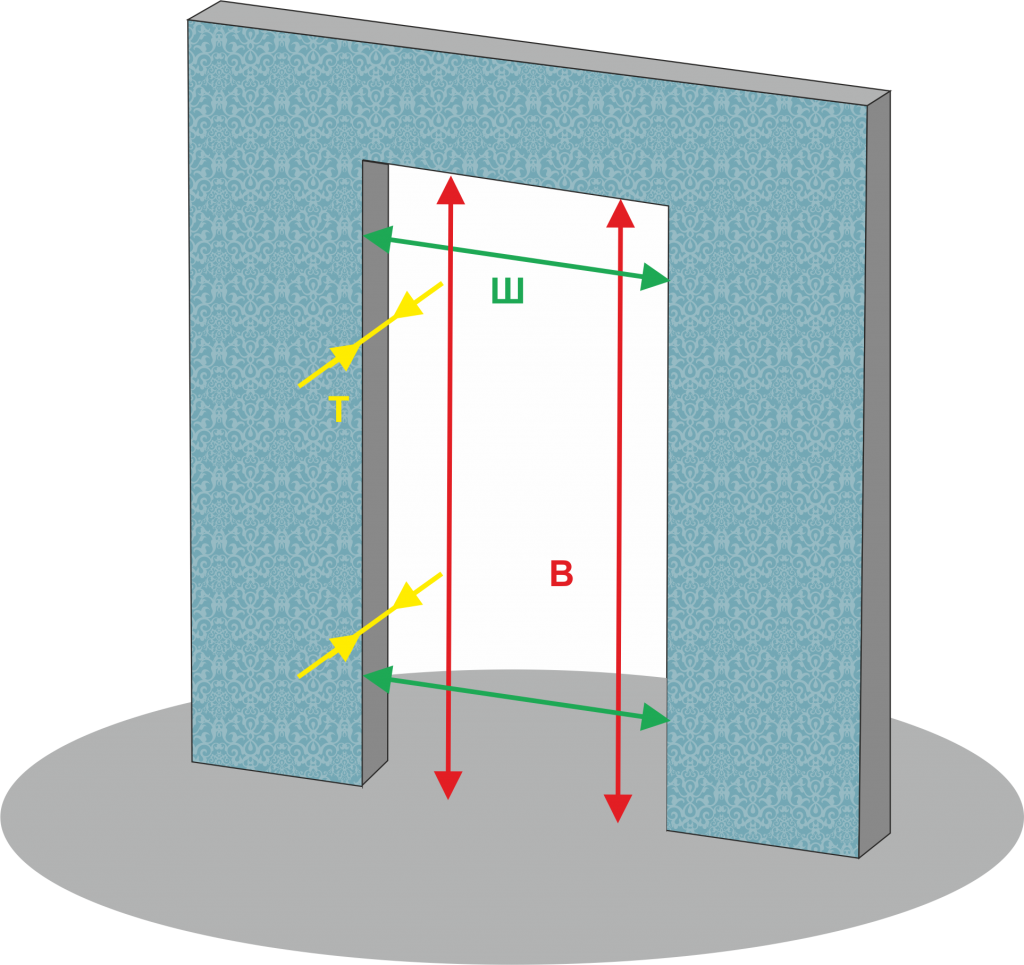


















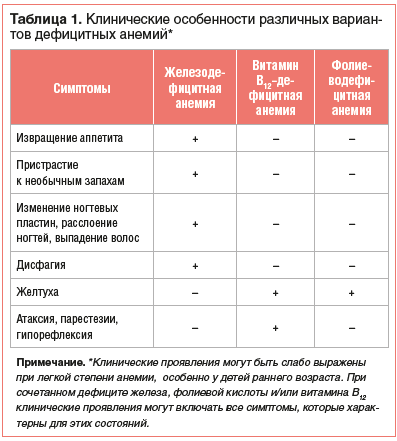
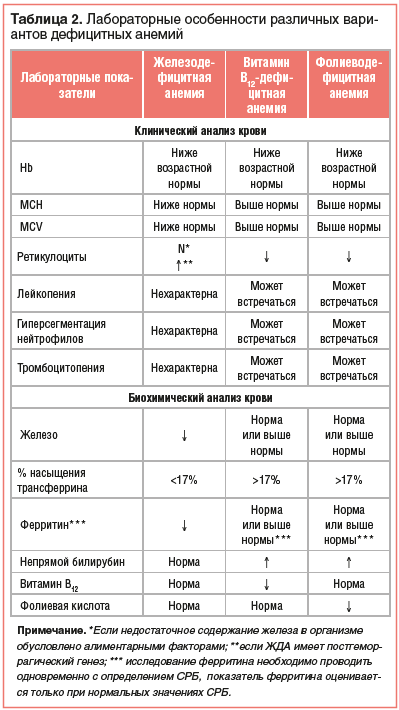




 Krayenbuehl PA, Battegay E, Breymann C, et al. Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood 2011; 118:3222.
Krayenbuehl PA, Battegay E, Breymann C, et al. Intravenous iron for the treatment of fatigue in nonanemic, premenopausal women with low serum ferritin concentration. Blood 2011; 118:3222.